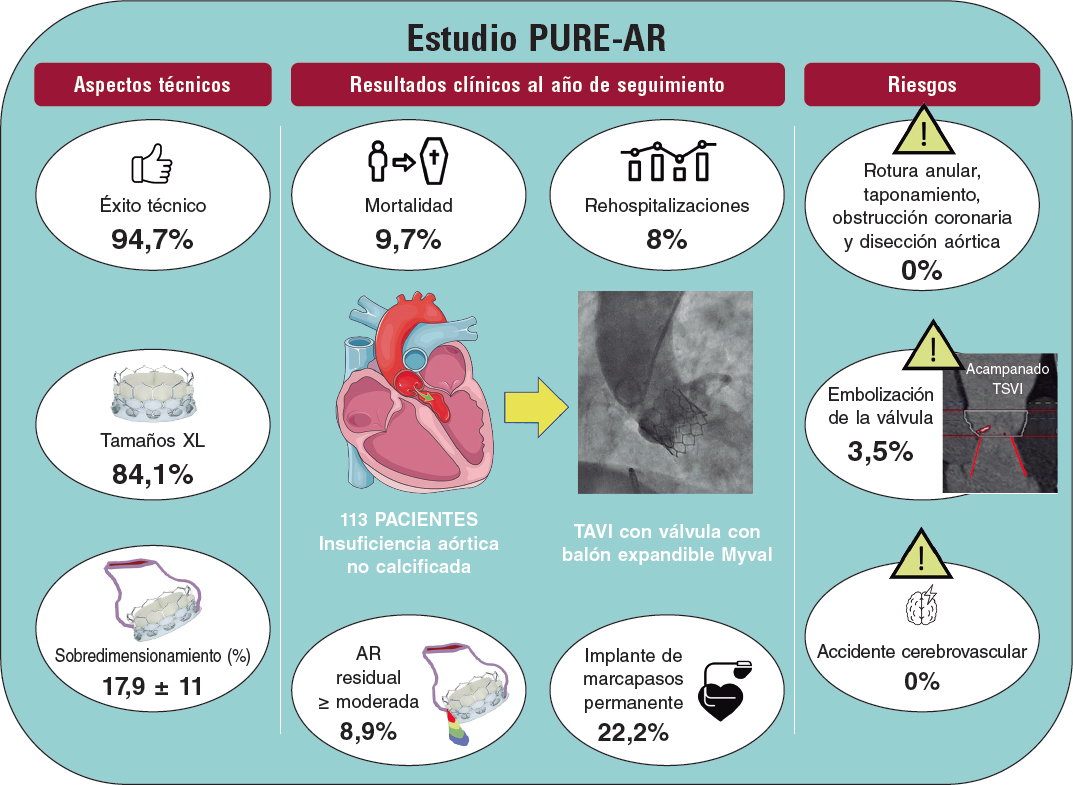
RESUMEN
Introducción y objetivos: A pesar de que el cateterismo cardiaco (CC) se ha convertido en una práctica habitual en el trasplante cardiaco (TxC) pediátrico, hay escasez de protocolos globales y de evidencia robusta sobre los procedimientos requeridos y el impacto que tienen en la evolución del propio trasplante y los futuros CC. Este estudio tiene como objetivo analizar la actividad de CC en niños receptores de trasplante cardiaco en un centro terciario y describir los factores de riesgo para un mayor número de procedimientos.
Métodos: Estudio retrospectivo con datos obtenidos de los informes médicos y los archivos de hemodinámica. La muestra se dividió en miocardiopatías y cardiopatías congénitas (CAC). El análisis de los factores de riesgo para CC se calculó con regresión lineal y ANOVA.
Resultados: Conformaron la muestra 61 niños (36,07% CAC). Las CAC muestran una mayor media de CC antes del TC. Los cateterismos diagnósticos son la actividad más frecuente previa al TxC, seguidos por las biopsias endomiocárdicas en las miocardiopatías y el cierre de colaterales aortopulmonares en las CAC. Hubo 389 CC tras el TC (608 procedimientos), la mayoría (92,75%) por vigilancia del rechazo. El subgrupo de CAC univentriculares tuvo significativamente un mayor número de CC tras el TxC (p = 0,03).
Conclusiones: A pesar de su larga expectativa de vida, los niños receptores de TxC sufren una morbilidad importante debido a los CC, por lo que es necesario establecer protocolos de seguimiento y vigilancia del rechazo para minimizar las intervenciones que necesitarán.
Palabras clave: Trasplante cardiaco pediátrico. Cateterismo cardiaco. Rechazo injerto. Biopsia endomiocárdica.
ABSTRACT
Introduction and objectives: Although cardiac catheterization (CC) has become a routine practice in pediatric heart transplantation (HT), there is still a shortage of widely used protocols and strong evidence on the number of procedures required and their impact on HT outcomes, as well as the need for further CC. This study aimed to analyze CC activity in pediatric HT recipients in a tertiary center and describe risk factors for a higher number of post-HT procedures.
Methods: This retrospective study obtained data from medical reports and image files. The sample was composed of patients with cardiomyopathies and congenital heart diseases (CHD). Risk factor analysis for CCs was conducted with linear regression and the ANOVA test.
Results: The sample included 61 children (36.07% with CHD). The CHD group had a higher mean number of CCs prior to HT. The most frequent activities prior to HT were diagnostic catheterizations, followed by endomyocardial biopsies for cardiomyopathies and aortopulmonary collaterals in CHD patients. There were 389 post-HT CCs (608 procedures). Most CCs were performed for rejection surveillance, accounting for 92.75% of procedures. The univentricular CHD subgroup was associated with a higher number of CC after HT (P = .03).
Conclusions: Despite long life expectancy, pediatric HT recipients have substantial morbidity due to these procedures. Therefore, it is necessary to establish protocols for follow-up and rejection surveillance to minimize the interventions required by these patients.
Keywords: Pediatric heart transplantation. Cardiac catheterization. Graft rejection. Endomyocardial biopsy.
Abreviaturas BEM: biopsia endomiocárdica. CAC: cardiopatía congénita. CC: cateterismo cardiaco. IVUS: ecografía intravascular. TxC: trasplante cardiaco.
INTRODUCCIÓN
El trasplante cardiaco (TxC) pediátrico es una intervención compleja y poco común que implica un seguimiento cercano de por vida. El TxC no es solo una cirugía mayor asociada a una complicada recuperación posoperatoria, sino que también requiere una vigilancia de por vida para la detección de rechazos y revisión de las anastomosis y de las posibles complicaciones quirúrgicas que pueda haber. Estas últimas se pueden estudiar mediante cateterismos cardiacos (CC), una práctica indispensable en el seguimiento de los TxC.
Algunos autores han estudiado si la enfermedad de base influye en la evolución de la cirugía post-TxC. Aunque la literatura médica disponible arroja resultados controvertidos y discrepantes, suele ser habitual que los pacientes con cardiopatías congénitas (CAC) presenten tasas más altas de intervenciones post-TxC con independencia del número de CC previos. Esto podría deberse a que las intervenciones diagnósticas son raras en pediatría, razón por la cual los cateterismos terapéuticos descritos se realizaron, principalmente, en pacientes con enfermedades congénitas. También se sabe que los receptores más jóvenes (sobre todo de menos de 1 año) y aquellos que sufren síndrome de hipoplasia del hemicardio izquierdo requieren más intervenciones1-3.
Por lo general, la biopsia endomiocárdica (BEM) es la intervención diagnóstica más utilizada de todas. La BEM es el patrón oro con el que diagnosticar los rechazos, puesto que, en la actualidad, no disponemos de pruebas no invasivas. La coronariografía nos permite monitorizar la vasculopatía del injerto cardiaco (CAV), un marcador del rechazo crónico, y la principal causa de muerte más allá del tercer año post-TxC. La ecografía intravascular (IVUS) es una herramienta diagnóstica avanzada adicional para la detección y clasificación de la CAV4,5.
Las intervenciones informadas tras un TxC son, principalmente, para tratar la estenosis del arco aórtico y las conexiones venosas sistémicas con la aurícula derecha. Esta última asociada sobre todo a menor peso, a mayor discrepancia de tamaño entre donante y receptor y a anatomías más complejas6,7.
Otras indicaciones para realizar CC son la evaluación hemodinámica de los síntomas congestivos y el diagnóstico de hipertensión pulmonar, ambos de suma importancia pues son marcadores de la necesidad de un nuevo trasplante8,9.
Como los casos de TxC pediátricos son raros, la mayoría de los centros están desarrollando protocolos para determinar la frecuencia con la que se deben realizar estos CC y cómo debe aplicarse la técnica, con el objetivo de establecer una práctica común y obtener mejores resultados. Por esta razón, conocer las intervenciones realizadas resulta esencial.
El objetivo del presente estudio fue, en primer lugar, determinar la actividad de los CC pediátricos realizados tras un TxC y, en segundo lugar, estudiar los factores de riesgo asociados a mayores requisitos de CC post-TxC, según la historia médica e intervenciones previas de los pacientes.
MÉTODOS
Este estudio retrospectivo incluyó a todos los receptores pediátricos receptores de un TxC menores de 18 años en el momento del TxC sometidos como mínimo a un CC post-TxC en un centro terciario de referencia entre 2002 y 2021. El estudio fue aprobado por el comité de ética local, con exención de formulario de consentimiento y según los principios establecidos en la Declaración de Helsinki.
Los datos revisados incluyen la historia médica de los pacientes, intervenciones quirúrgicas y CC previos, datos demográficos y las complicaciones descritas durante la realización del TxC. Se recopilaron los datos de todos los CC realizados tras el TxC: material utilizado, tiempo desde que se realizó el TxC, las intervenciones específicas y los diagnósticos realizados de cada participante. Debido a su diferente presentación y avance, aquellos pacientes con miocardiopatías y CAC fueron estudiados por separado en algunos de los análisis. La definición de intervención fue todo aquel procedimiento/técnica realizado y cada visita a la sala de hemodinámica se consideró un CC aislado.
Debido al carácter retrospectivo del estudio y el grupo de edad de los pacientes, el género de los pacientes se extrajo del sexo documentado y asignado en el certificado de nacimiento o historia médica de los pacientes.
Las variables cualitativas se expresaron como porcentajes y las cuantitativas como media y desviación estándar (DE) o mediana y rango intercuartílico (RIQ). Las diferencias se analizaron mediante las pruebas exacta de Fisher, X2, U de Mann-Whitney o t de Student, según el tipo de variable. Se examinaron los factores de riesgo para más requisitos post-TxC con regresión lineal y pruebas de ANOVA. Los valores p < 0,05 se consideraron significativos a nivel estadístico.
El número de CC requeridos para cada paciente siguió el protocolo de la unidad de Cardiología Pediátrica. Este protocolo indica la realización BEM en determinados momentos: entre 10 y 14 días post-TxC, 1, 3, 6, 12 y 24 meses post-TxC y, a partir de ahí, cada 2 años. Ante la sospecha clínica de rechazo, se realizan CC extra. Luego de confirmarse este (entendido como grados ≥ 2 en celular y ≥ 1 en humoral), se realiza una BEM de seguimiento 2 semanas después del tratamiento adecuado. Las muestras de las BEM se obtienen de la región derecha del septo interventricular introduciendo un biotomo de 6 Fr en la vena yugular derecha. Durante los primeros 3 a 6 meses suele realizarse una coronariografía rutinaria y, a partir de ahí, cada 2 años junto con la BEM. Se realiza la ecografía intravascular (IVUS) en la descendente anterior asociada a la coronariografía en pacientes que pesan > 20 kg. Los hallazgos patológicos se definen como grosor de la túnica íntima ≥ 0,5 mm.
RESULTADOS
Datos demográficos y del trasplante cardiaco
Se incluyó a un total de 61 participantes, 37 de los cuales (60,66 %) eran varones. La enfermedad de base fue una CAC en 22 pacientes (36,07 %) y miocardiopatía en 39 (64,93 %). Cinco participantes (8,20 %) fueron clasificados como portadores del síndrome de hipoplasia del hemicardio izquierdo. Todos los pacientes con CAC habían recibido, como mínimo, 1 intervención quirúrgica cardíaca previa al TxC.
La media de edad en el momento en que se realizó el TxC fue de 96,24 ± 89,47 meses, no observándose ninguna diferencia entre los grupos. En muchos más pacientes del grupo con CAC que del grupo con miocardiopatías (40,00 frente al 10,26 %; p = 0,005) hubo que emplear algún sistema de soporte vital extracorpóreo (ECMO) post-TxC y las estancias en la unidad de cuidados intensivos pediátricos (UCIP) fueron más largas. En ambos grupos, la clasificación funcional de la New York Heart Association pre-TxC se mantuvo entre los grados 3 y 4.
Al dividir los años del estudio en 2 periodos (2002-2015 y 2016-2021) se pudo observar que el número de receptores de TxC aumentó con el paso de los años. Aunque la miocardiopatía fue la enfermedad de base más común en ambos periodos, los pacientes con CAC mostraron un aumento no significativo a nivel estadístico (el 22,23% de los pacientes durante el primer período y el 35,71% durante el segundo periodo de 5 años [p = 0,722]). Tanto la tabla 1 como la figura 1 ilustran tanto los datos demográficos como los relacionados con el trasplante.
Tabla 1. Datos demográficos y del trasplante cardiaco
| Variables demográficas y del trasplante cardiaco | Total | Miocardiopatía | Cardiopatía congénita | p |
|---|---|---|---|---|
| Número de pacientes | 61 | 39 | 22 | |
| Sexo masculino | 37 (60,66) | 23 (58,97) | 14 (63,64) | 0,403 |
| Pacientes con 1 intervención quirúrgica cardiaca previa | 27 (44,26) | 25 (64,10) | 2 (10) | 0,029* |
| Pacientes con 2 intervenciones quirúrgicas cardiacas previas | 18 (29,51) | 0 (0) | 18 (81,81) | < 0,001* |
| Fisiología univentricular | 10 (16,39) | 0 (0) | 10 (50) | < 0,001* |
| Síndrome de hipoplasia del corazón izquierdo | 5 (8,20) | 0 (0) | 5 (22,73) | 0,02* |
| Pacientes con cianosis | 9 (14,75) | 0 (0) | 9 (45) | < 0,001* |
| HP | 17 (27,87) | 7 (17,95) | 10 (50) | 0,377 |
| N.º de tratamientos contra la HP | 0 (0) | 0 (0) | 1,5 (0-4) | 0,075 |
| Edad (meses) en el momento del trasplante | 74,00 (20,00-168,00) | 72,00 (20,00-127,00) | 77,50 (24,25-169,50) | 0,440 |
| Peso (kg) en el momento del trasplante | 31 (11,80-45,00) | 22,00 (10,85-40,50) | 35,00 (17,50-56,00) | 0,067 |
| Pacientes que precisaron ECMO post-TxC | 12 (19,67) | 4 (10,26) | 8 (40) | 0,005* |
| Días en la UCIP post-TxC | 15,5 (10,75-30) | 14,00 (9,75-24,50) | 26,50 (12,75-76,25) | 0,035* |
ECMO: sistema de soporte vital extracorpóreo; HP: hipertensión pulmonar; RIQ: rango intercuartílico; UCIP: unidad de cuidados intensivos pediátricos, Las variables cualitativas expresan números absolutos y porcentajes y las cuantitativas, medianas y rangos intercuartílicos. * Significación estadística de las pruebas t de Student o de la X2. | ||||
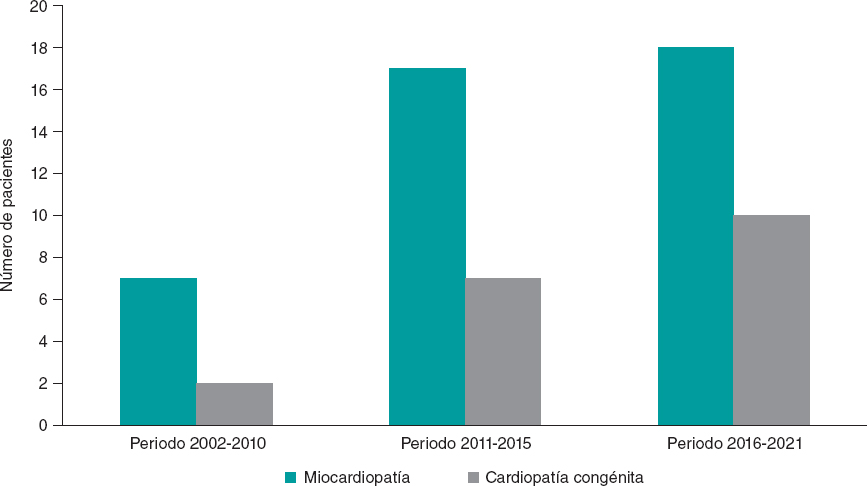
Figura 1. Distribución de la cardiopatía de base en el tiempo.
Cateterismos cardiacos previos al trasplante de corazón
El número de pacientes con, como mínimo, 1 CC no varió entre los grupos con CAC y miocardiopatías (p = 0,07). No obstante, el número medio de CC previos fue mucho mayor en pacientes con CAC (p = 0,014). En el grupo con miocardiopatías, los CC se realizaron, sobre todo, con fines diagnósticos (45,00%), seguidos de BEM (16,70%) y atrioseptostomías con stent de descarga de la cavidad izquierda en ECMO (15%). Se realizaron 8 coronariografías, 1 IVUS, 2 angioplastias con balón y 3 angioplastias con stent en las arterias OM1 y circunfleja izquierda. Las intervenciones relacionadas con la coronariografía se realizaron en 1 único paciente que previamente había recibido un TxC.
En el grupo con CAC, se realizaron principalmente CC con fines diagnósticos (el 57,30% de las intervenciones) seguidos de cierres de colaterales aortopulmonares mayores (11,0% de la actividad) y angioplastias con stent de las arterias pulmonares (10,26 %).
Un mayor número de intervenciones diagnósticas no se asociaron a las tareas de vigilancia del rechazo en el grupo con CAC, si bien esta diferencia no fue significativa a nivel estadístico. No obstante, el seguimiento de los rechazos fue mucho más predominante en el grupo con miocardiopatías (57,3% y 75,0% en los grupos con CAC y miocardiopatías, respectivamente).
Cuando el estudio fue dividido en 2 periodos de tiempo, de 2002 a 2014 y de 2015 a 2021, se observó una mediana de 0 intervenciones por persona [RIQ, 0-2] en el primer periodo y 2 [RIQ, 0-3,25] en el segundo, indicativo de una tendencia hacia una mayor actividad, aunque sin significación estadística (ver tabla 2 para obtener más información).
Tabla 2. Datos sobre cateterismos cardiacos pre-trasplante
| Intervenciones pre-TxC | Miocardiopatía (n = 39) | Cardiopatía congénita (n = 22) | p |
|---|---|---|---|
| Pacientes con CC previos | 17 (43,59%) | 18 (81,82%) | 0,282* |
| 1 CC | 12 | 6 | 0 |
| 2 CC | 2 | 1 | 0 |
| 3 CC | 2 | 5 | 0 |
| 4 CC | 1 | 1 | 0 |
| > 5 CC | 0 | 5 | 0 |
| CC por persona; mediana (IQR) | 0 (0-1) | 2,5 (1-3,75) | 0,014* |
| N.º de intervenciones previas | 60 | 82 | 0 |
| N.º de procedimientos intervencionistas previos | 15 | 35 | 0 |
| Atrioseptostomía con balón | 2 | 0 | 0 |
| Atrioseptostomía con stent | 5 | 3 | 0 |
| Angioplastia coronaria con stent | 3 | 0 | 0 |
| Redilatación del stent interauricular | 2 | 0 | 0 |
| Angioplastia coronaria con balón | 2 | 0 | 0 |
| IVUS | 1 | 0 | 0 |
| Cierre de las arterias colaterales sistémico-pulmonares | 0 | 9 | 0 |
| Angioplastia de ramas pulmonares con stent | 0 | 9 | 0 |
| Angioplastia con balón de laanastomosis cavopulmonar | 0 | 2 | 0 |
| Angioplastia con stent de la anastomosis cavopulmonar | 0 | 1 | 0 |
| Valvuloplastia aórtica | 0 | 3 | 0 |
| Cierre comunicación interventricular | 0 | 2 | 0 |
| Embolización de fístula coronaria | 0 | 2 | 0 |
| Angioplastia con stent del tronco pulmonar | 0 | 1 | 0 |
| Angioplastia con balón de vena cava superior | 0 | 1 | 0 |
| Dilatación del stent iliaco (migración previa) | 0 | 1 | 0 |
| Fenestración de Fontan (fracaso) | 0 | 1 | 0 |
| Intervenciones diagnósticas (índice total de intervenciones) | 45 (75,0%) | 47 (57,3%) | 0,029* |
| Coronariografía | 8 | 4 | 0 |
| Biopsia endomiocárdica | 10 | 0 | 0 |
| Cateterismo diagnóstico | 27 (45,0%) | 43 (52,4%) | 0,380 |
CC: cateterismo cardiaco; ECMO: sistema de soporte vital extracorpóreo; IVUS: ecografía intravascular. Las variables cualitativas expresan números absolutos y porcentajes y las cuantitativas, medianas y rangos intercuartílicos. * Significación estadística. | |||
Cateterismo cardiaco tras cirugía de trasplante de corazón
Tras la cirugía de TxC, se realizaron un total de 389 CC, correspondientes a 608 intervenciones. El número medio de intervenciones por CC fue de 1,37 ± 0,83 y el número medio de CC por persona, 6,71 ± 4,13.
La mediana del número de intervenciones por persona fue de 13 [RIQ, 9-17] en el primer periodo (2002-2015) y 8 [RIQ, 2-9.25] en el segundo (2016-2021) debido al menor tiempo de seguimiento de este último periodo.
Seguimiento de los rechazos
La mayoría de los CC se realizaron para el seguimiento de los rechazos: las BEM representaron el 63,10% de la actividad post-TxC, las coronariografías el 18,29% y las IVUS el 11,53%. El número de estudios de seguimiento realizados fue mucho mayor en pacientes con miocardiopatías que con CAC. La BEM dio positivo para rechazo celular y humoral en el 7,39% y 3,17% de los casos, respectivamente. Hasta el 9,40 % de las BEM fueron de seguimiento por rechazos diagnosticados en un CC previo.
La CAV se diagnosticó en el 6,71% de las coronariografías. La coronaria más afectada fue la descendente anterior (en el 36% de los estudios positivos) seguida del ostium coronario izquierdo, la circunfleja izquierda y la arteria bisectriz (un 14% cada una). No se hallaron diferencias según la cardiopatía de base, con tasas de positividad del 29,07 y 16,67%, respectivamente, para las miocardiopatías y la CAC.
El 31,43% de los pacientes sometidos a IVUS (n = 70) cumplió los criterios de positividad.
Tampoco se hallaron diferencias en el índice de positividad asociado a las cardiopatías de base (con tasas de positividad del 29,07% y 13,33%, respectivamente, en los grupos con miocardiopatías y CAC).
El tiempo medio trascurrido hasta el diagnóstico de CAV fue de 37,1 meses [RIQ, 13-47,5] tras el TxC, correspondiente al 4º-13er CC.
Procedimientos intervencionistas
Las técnicas más comunes fueron angioplastias con balón en vena cava superior y arteria pulmonar (representativas, cada una de estas, del 20,45% de los procedimientos intervencionistas realizados y correspondientes al 18,03% (n = 11) de los pacientes para la vena cava superior y a 4 pacientes para las arterias pulmonares.
La angioplastia de la vena cava se realizó a una mediana de tiempo de 2,5 meses [RIQ, 0,75-6] meses post-TxC, y ocurrió en el 40% de las intervenciones (6) durante los primeros 2 meses.
Se llegó al diagnóstico de estenosis de la vena cava superior tras la aparición de síntomas clínicos y derrame pericárdico (2 y 1 paciente, respectivamente). En 1 paciente, los signos de hepatopatía congestiva llevaron al diagnóstico de estenosis de la vena cava inferior. Las indicaciones restantes se deibieron a los hallazgos ecocardiográficos o a las observaciones hechas durante la biopsia. Tanto la edad (63,6 frente a 90,6 meses) como el peso medios de los pacientes tratados de angioplastia de la vena cava superior con balón o stent fueron menores cuando se realizó el TxC, si bien es cierto que hubo más discrepancias, no significativas a nivel estadístico, en los ratios de peso (p = 0,233, p = 0,243 y p = 0,605, respectivamente). Este grupo no recibió más intervenciones quirúrgicas previas (p = 0,460) ni tenía más requisitos para el uso de ECMO (p = 0,253). Tampoco se observó una mayor proporción de pacientes con CAC en el grupo con estenosis de la vena cava (p = 0,221). En 3 pacientes se realizó más de 1 angioplastia debido a la reestenosis.
La angioplastia pulmonar, con balón o stent, se hizo necesaria, sobre todo, en las ramas pulmonares. La mediana de tiempo trascurrido desde el trasplante hasta la angioplastia pulmonar fue de 4 meses [RIQ, 2-26], 3 de las cuales se realizaron durante los primeros 2 meses tras la cirugía.
Los tratamientos coronarios solo fueron necesarios en 2 ocasiones, 1 angioplastia con stent y otra en 1 trombólisis.
Las angioplastias de las arterias pulmonares con balón (p < 0,001) o stent (p = 0,011), de la vena cava superior con stent (p = 0,038) y de los conductos entre el ventrículo derecho y la arteria pulmonar (p = 0,037) fueron más habituales en pacientes con CAC (ver la tabla 3 y la figura 2 para una descripción más detallada).
Tabla 3. Actividad postrasplante y comparativa entre grupos según enfermedades de base
| Intervenciones post-TxC | Total | Miocardiopatía | Cardiopatía congénita | p |
|---|---|---|---|---|
| Angioplastia con balón de vena cava superior | 9 | 4 | 5 | 0,125 |
| Angioplastia con balón de la arteria pulmonar | 9 | 0 | 9 | < 0,01* |
| Estudio de resistencias pulmonares | 6 | 2 | 4 | 0,066 |
| Angioplastia con balón de vena cava inferior | 3 | 2 | 1 | 0,957 |
| Angioplastia con stent de la arteria pulmonar | 3 | 0 | 3 | 0,011* |
| Intervenciones asociadas a trombos en la vena cava | 3 | 1 | 2 | 0,195 |
| Angioplastia balón de la vena innominada | 2 | 1 | 1 | 0,582 |
| Angioplastia con stent en vena cava superior | 2 | 0 | 2 | 0,038* |
| Angioplastia con balón en conductos entre el ventrículo derecho y la arteria pulmonar | 2 | 0 | 2 | 0,038* |
| Angioplastia con stent en vena cava inferior | 1 | 1 | 0 | 0,493 |
| Angioplastia coronaria con stent | 1 | 1 | 0 | 0,493 |
| Trombólisis de coronaria marginal | 1 | 1 | 0 | 0,493 |
| Pericardiocentesis | 1 | 1 | 0 | 0,493 |
| Total | 44 | 14 | 29 | |
| Actividad durante el seguimiento de los rechazos | ||||
| Biopsia endomiocárdica | 383 | 255 | 128 | 0,274 |
| Coronariografía | 111 | 89 | 22 | 0,001* |
| IVUS | 70 | 55 | 15 | 0,046* |
| TOTAL | 564 | 399 | 164 | |
CC: cateterismo cardiaco; ECMO: sistema de soporte vital extracorpóreo; IVUS: ecografía intravascular. Las variables cualitativas expresan números absolutos y porcentajes y las cuantitativas, medianas y rangos intercuartílicos. * Significación estadística. | ||||
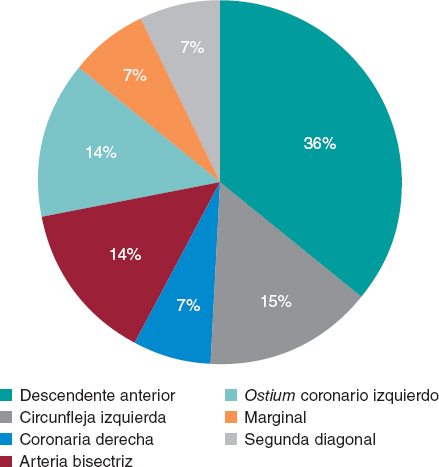
Figura 2. Distribución de la arteria afectada según la coronariografía.
Generalidades
La duración media de los CC fue de 64,65 ± 38,02 min. Cuando se dividió a los participantes en 2 periodos (2002-2015 y 2016-2021), se observó que se realizaron muchas más intervenciones (p < 0,001) por persona durante el primer periodo (media de 12,67 ± 7,55) que durante el segundo (media de 6,54 ± 4,05).
Hubo complicaciones, sistémicas y locales, y de distinta gravedad, en el 2,80% de todos los CC realizados. Las sistémicas fueron 1 depresión del segmento ST al inicio de la intervención que se resolvió espontáneamente, 1 flutter auricular refractario a la sobreestimulación auricular pero que pudo resolverse mediante cardioversión eléctrica, 1 broncoespasmo con inducción anestésica que requirió ingreso en la UCIP para extubación electiva (realizada tras 24 horas), 2 espasmos de la coronaria derecha que se revirtieron con nitroglicerina, sendos bloqueos auriculoventricular temporal de segundo y tercer grado que precisaron epinefrina, 1 crisis hipertensiva pulmonar que se trató de forma efectiva en la sala de hemodinámica, 1 insuficiencia tricuspídea moderada y 1 síndrome de encefalopatía posterior reversible. Las complicaciones locales fueron 1 hematoma en el sitio de punción y 1 vasoespasmo de la arteria femoral.
La distribución según el período de tiempo reveló una tasa de complicaciones del 1,91% en el primer período (2002-2015) y del 1,64% en el segundo (2016-2021). Los pacientes con ECMO representaron el 1,60% de la actividad desplegada. Durante los primeros 6 meses tras el TxC, el ECMO se usó en el 47,56% de las intervenciones (figura 3).
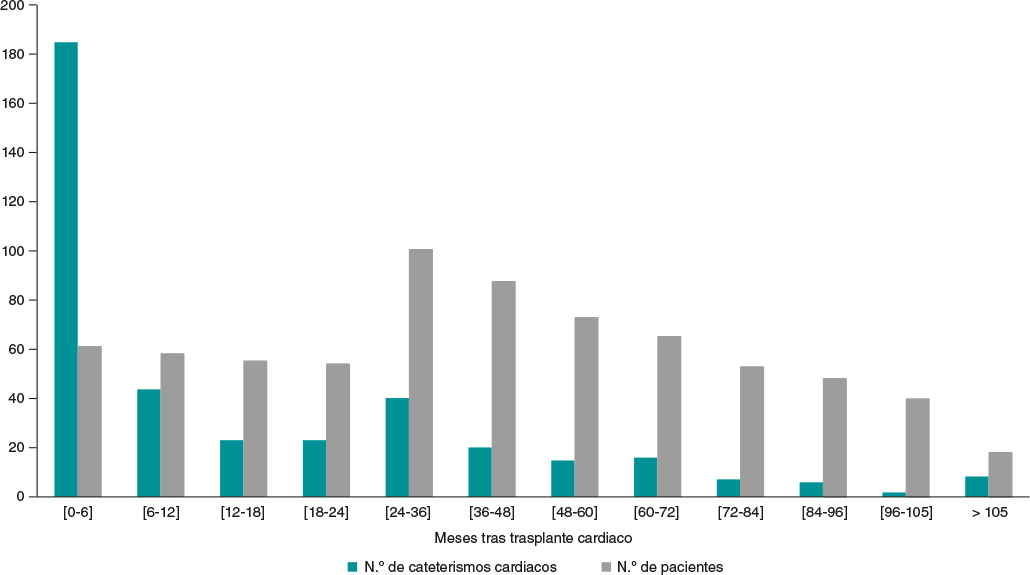
Figura 3. Variación en la frecuencia de los cateterismos cardiacos según el tiempo trascurrido desde el trasplante y número de pacientes durante el seguimiento.
El seguimiento medio de los pacientes fue de 6,48 ± 4,07 años. La tasa de supervivencia en este punto fue del 88,52%. No se observó ninguna relación significativa en el análisis de los factores de riesgo de mortalidad que estudió el número de CC pre-TxC, el número de intervenciones terapéuticas, el número total de CC post-TxC y el número de pacientes tratados de angioplastia de la vena cava superior o arteria pulmonar.
Análisis de los factores de riesgo para una mayor necesidad de intervenciones
En el análisis de los factores asociados a un mayor número de CC post-TxC, no se halló ninguna correlación con el número de procedimientos intervencionistas (p = 0,149) o CC previos (p = 0,059), así como tampoco con haber recibido, como mínimo, 1 CC previo (p = 0,107). El subgrupo de pacientes con CAC univentriculares requirió muchos más CC post-TxC (p = 0,03). Ni el peso ni la edad a la realización del TxC guardaron relación significativa a nivel estadístico con la necesidad de realizar posteriores CC. Tampoco se observó que la mayor discrepancia de peso entre donante y receptor fuese una factor predictivo. La mayor necesidad de procedimientos intervencionistas tampoco se asoció a la duración de la estancia en la UCIP, al número de días con ventilación mecánica ni a la historia médica de hipertensión pulmonar o insuficiencia renal. Los seguimientos más largos se asociaron a más CC por el mayor período de tiempo estudiado (tabla 4).
Tabla 4. Estudio de los factores asociados a la necesidad de cateterismo tras trasplante cardiaco
| Variable | Resultado del test | p |
|---|---|---|
| Tipo de cardiopatía | Prueba U de Mann-Whitney = 555,5 | 0,142 |
| Fisiología univentricular | Prueba de Krustall Wallis = 4,71 | 0,030* |
| Cirugía previa | Prueba de Krustall Wallis = 2,52 | 0,284 |
| Hipertensión pulmonar pre-TxC | Prueba U de Mann-Whitney = 281 | 0,134 |
| N.º de tratamientos contra la hipertensión pulmonar | R2 = -0,186; IC95%, -0,419 - 0,069 | 0,150 |
| N.º de cateterismos cardiacos previos | R2 = -0,233; IC95%, -0,460- 0,220 | 0,073 |
| N.º de procedimientos intervencionistas previos | R2 = -0,19; IC95%, -0,426 - 0,069 | 0,149 |
| Insuficiencia renal pre-TxC | Prueba U de Mann-Whitney = 358 | 0,755 |
| Edad en el momento de la realización del TxC | R2 = -0,001; IC95%, -0,388 - 0,109 | 0,992 |
| Peso en el momento de la realización del TxC | R2 = -0,072; IC95%, -0,183 - 0,318 | 0,583 |
| Diferencias de peso (ratio donante-receptor) | R2 = 0,0164; IC95%, -5,39 - 1,93 | 0,347 |
| Duración de la hospitalización en la unidad de cuidados intensivos pediátricos | R2 = 0,038; IC95%, -0,249 - 0,319 | 0,798 |
| Días de tratamiento con ventilación mecánica invasiva | R2 = 0,140; IC95%, -0,325 - 0,255 | 0,348 |
| Duración del seguimiento del estudio | R2 = 0,394; IC95%, 0,158 - 0,588 | 0,002* |
IC95%: intervalo de confianza del 95%; R2: correlación de Pearson; TxC: trasplante cardiaco. * Significación estadística. | ||
DISCUSIÓN
En este estudio, se evaluó la actividad de CC pediátricos asociados a TxC en un centro terciario de referencia. Participaron 61 pacientes y se realizaron 607 intervenciones. La mayor parte de la actividad desplegada tras el TxC tuvo por objeto hacer seguimiento de los posibles rechazos (el 92,75% de las intervenciones). La intervención más habitual fue la BEM seguido de la coronariografía y la ecografía intravascular, que posibilitaron el diagnóstico de la vasculopatía crónica del aloinjerto (figura 4).
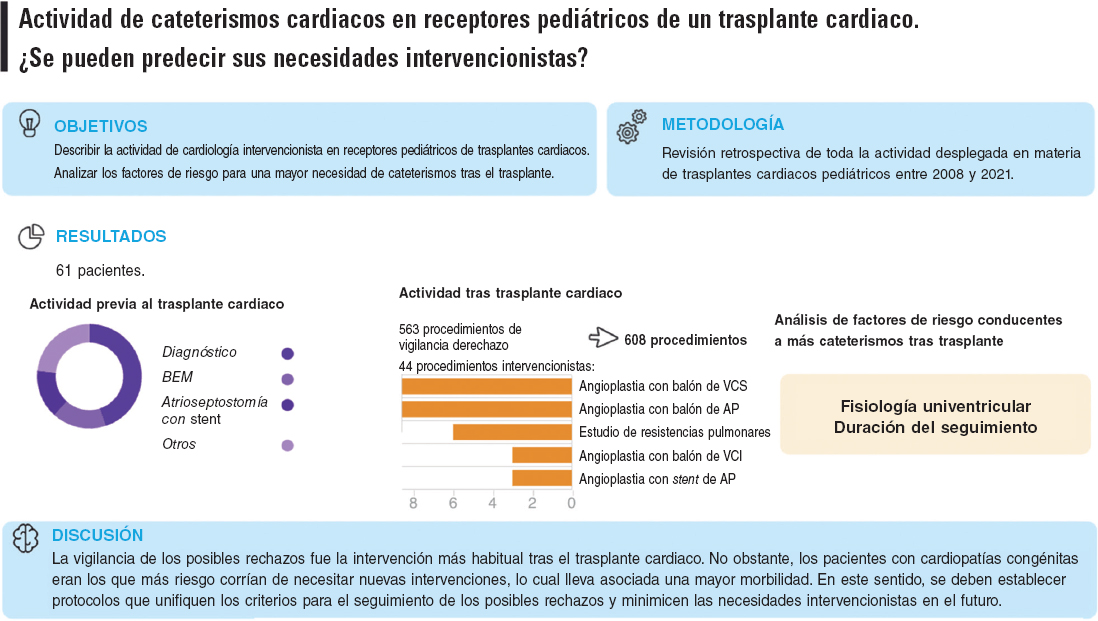
Figura 4. Figura central. Puntos clave del artículo. AP: arterias pulmonares; atrio_stent: atrioseptostomía con stent; BEM: biopsia endomiocárdica; VCI: vena cava inferior; VCS: vena cava superior.
Esta distribución va en consonancia con la de otras publicaciones. Un estudio multicéntrico que incluyó a casi 50.000 CC pediátricos realizados en Filadelfia (Estados Unidos) encontró que las técnicas diagnósticas más habituales asociadas al TxC fueron los CC incluidas la BEM10.
La IVUS fue la técnica de imágen más sensible para la detección de vasculopatía coronaria del aloinjerto, lo cual no es sorprendente pues es una técnica que permite hacer diagnósticos más detallados que la coronariografía. En nuestro estudio, se obtuvieron resultados positivos en el 6,71% de las coronariografías realizadas frente al 31,43% de las IVUS. En este sentido, la IVUS permite diagnosticar e implementar las medidas correspondientes inmunosupresoras mucho antes.
El seguimiento del rechazo representó una tasa relativa más alta a nivel estadístico de la actividad desplegada en pacientes con miocardiopatías que en los congénitos, debido a que los participantes con CAC también precisaron otros tipos de intervenciones secundarias a intervenciones quirúrgicas previas o a las secuelas de la propia CAC. Un ejemplo de esto sería el subdesarrollo de las ramas pulmonares, un hallazgo habitual en pacientes cianóticos o univentriculares con bandas previas o fístulas sistémico-pulmonares que, al no poderse reemplazar en cirugías de TxC, se dejan intactas durante el TxC para acortar el tiempo quirúrgico para abordarlas, después, de manera percutánea.
Nuestro protocolo, descrito en la sección Métodos, es similar al de otros centros, como el del Hospital Universitario de Helsinki que realiza BEM cada 1-2 semanas durante las primeras 4 a 6 semanas tras la cirugía en niños mayores de 24 meses. Tras el alta del paciente, se realiza una BEM a los 3, 6, 12, 18 meses y, a partir de entonces, cada año hasta que el paciente alcance la edad adulta. La coronariografía se realiza anualmente11. Aunque un tercio de las IVUS dieron positivo para CAV, solo hubo que implantar 1 stent en 1 paciente. Estos resultados difieren de los datos en adultos, cuyo sistema inmunológico maduro, en estos casos, resulta perjudicial12.
En lo referente a los cateterismos intervencionistas, más de la mitad de las intervenciones terapéuticas se debieron a estenosis de anastomosis, principalmente de la vena cava superior y arterias pulmonares, predominantemente a nivel de las ramas seguidas del tronco común. Las angioplastias de la vena cava inferior y los tratamientos coronarios fueron menos habituales, incluidos los implantes de stents y las trombectomías mecánicas.
En nuestro estudio, el 13,11% de los pacientes presentó tasas de obstrucción de la vena cava superior. Salavitabar et al.5 ya hablan de prevalencias de las obstrucciones en la vena cava superior en TxC del 3,4%, diagnosticadas clínicamente secundarias a síndromes de la vena cava superior o derrames quilosos o de forma ecocardiográfica. Todos estos pacientes recibieron 1 angioplastia durante los primeros 10 meses tras la cirugía, y hasta dos tercios de estas se realizaron durante los primeros 2 meses. Los factores de riesgo significativos a nivel estadístico para el implante de stents en la vena cava superior que encontraron fueron una menor edad, un peso del receptor más bajo, los antecedentes de CAC y las anastomosis cavopulmonares previa. En nuestra cohorte, no se hallaron diferencias significativas a nivel estadístico en estos factores en el grupo con estenosis de la vena cava superior. Los autores proponen medir la presión a nivel de la aurícula derecha y vena cava superior (VCS) en las BEM que se realizan de manera rutinaria en pacientes con estas características de riesgo. En nuestro centro, se miden las presiones en las cavidades derechas del corazón en las BEM que realizamos de forma habitual. No se diagnosticó ningún caso de trombosis de stent en el estudio de Salavitar et al.5. Su protocolo incluye un curso de tratamiento (3 a 6 meses) con enoxaparina cuando se implanta un stent. Sachdeva et al.13 informaron de tasas de obstrucciones de la vena cava superior con implante de stent del 5,1% en una cohorte pediátrica de TxC frente a nuestra tasa del 13,11%. La edad media en el momento del TxC en estos 7 pacientes fue menor que en nuestra cohorte (9 frente a 63,6 meses) y su peso medio, también (8,7 frente a 10,5 kg). A pesar de las tasas más bajas de obstrucción de la vena cava superior que las descritas en nuestra cohorte, la mediana de seguimiento fue más corta (48 meses) que en nuestro estudio (ver resumen en la figura 4). Tadros et al.14 informaron de una incidencia de la estenosis de la vena cava superior del 30%, de las que se intervino quirúrgicamente al 6%. Los factores de riesgo para su desarrollo fueron un menor peso, menor edad y cirugías cavopulmonares o intervenciones en la vena cava previas.
Una posible explicación del mayor número de estenosis de la vena cava superior descrito en nuestro estudio con respecto a otras publicaciones científicas podría ser la compleja anatomía de la mayoría de nuestros receptores de TxC, con CAC, varias intervenciones quirúrgicas previas y anatomías venosas anómalas, en algunos casos. La elección inicial entre realizar una angioplastia simple o implantar un stent en pacientes pediátricos está condicionada por múltiples factores, no solo por buscar el mejor resultado final de la intervención. Estos factores incluyen el pequeño tamaño del paciente y del stent, la necesidad de realizar múltiples dilataciones consecutivas con balón para adaptarse al crecimiento del paciente, el alto riesgo de atrapamiento de la válvula pulmonar durante el implante de stent en el tronco pulmonar, la alta probabilidad de nuevos TxC en el futuro y el objetivo de evitar el implante de stents en suturas, entre otras consideraciones. Estos factores podrían hacer que se modificara la estrategia inicial de implantar un stent en favor de un enfoque de angioplastia simple en anatomía propicias y ante la posibilidad de lograr resultados finales aceptables.
La estenosis pulmonar representó el 27,27% de la actividad terapéutica intervencionista desplegada en este trabajo, correspondiente a 4 pacientes (6,55%). Este porcentaje es más alto que el descrito en el único artículo hallado en la literatura médica, con tasas del 1,44%2. Una posible explicación de esta discrepancia es que el presente estudio incluyó a más pacientes con CAC.
Se realizaron pocas intervenciones coronarias tal y como se informa en otros estudios como en el American and Canadian pediatric heart transplant study, en el que fue necesario revascularizar al 0,90% de sus pacientes15.
Hasta donde nosotros sabemos, este es el primer estudio que analiza los factores predisponentes y asociados a la realización de un mayor número de CC post-TxC. El antecedente de fisiología univentricular fue significativo a nivel estadístico, no así el número de procedimientos intervencionistas o cateterismos pre-TxC. No se hallaron diferencias en función de la edad ni el peso del paciente en el momento del TxC. El peor estado basal, como por ejemplo, pacientes con hipertensión pulmonar o insuficiencia renal, o la presencia de complicaciones perioperatorias, como estancias más largas en la UCIP o empleo del soporte con ventilación mecánica, no guardaron una relación significativa a nivel estadístico en nuestro estudio. Se decidió no realizar un análisis multivariado por la falta de variables univariadas significativas.
Se sabe que el corazón hipoplásico empeora los resultados del TxC tal y como revela nuestro estudio2. Sin embargo, una publicación de Miyamoto et al.3 no halló un mayor riesgo de angioplastia pulmonar en pacientes con SHVI tratados de banding pulmonar bilateral.
Limitaciones
Las limitaciones de este estudio son las inherentes a estudios retrospectivos, aunque existe una base de datos rigurosa y amplia sobre todos los CC realizados en nuestro centro. Otra limitación es que el estudio se realizó en un único centro, por lo que sería recomendable obtener datos de un estudio multicéntrico. Un mayor tiempo de seguimiento habría permitido una interpretación más amplia y rigurosa de los resultados, sobre todo, en lo referente a los resultados de la vasculopatía coronaria del aloinjerto. Además, se necesitan más estudios sobre los factores de riesgo que pueden aumentar los requisitos de CC post-TxC.
La naturaleza retrospectiva de este trabajo en una población pediátrica significa que el género se asignó de acuerdo con el sexo asignado al nacer y documentado en la historia clínica; en este sentido, no se pudo cumplir con las directrices SAGER.
CONCLUSIONES
Aunque los receptores de TxC pediátricos tienen una esperanza de vida larga, experimentan una morbilidad considerable por los procedimientos intervencionistas que se les realizan, sobre todo por el seguimiento de los posibles rechazos. Es importante entender la actividad intervencionista que se realiza en estos pacientes. A pesar de encontrar significancia estadística solo en la fisiología univentricular como factor asociado a un mayor número de CC post-TxC, sí se observó una cierta tendencia de mayor riesgo ante la presencia de intervenciones previas y pacientes más pequeños.
Se necesitan estudios multicéntricos con muchos pacientes y un seguimiento prolongado que nos permita establecer protocolos de seguimiento para estos pacientes.
FINANCIACIÓN
Ninguna.
¿QUÉ SE SABE DEL TEMA?
- Los receptores pediátricos de TxC reciben muchos CC, lo cual acarrea múltiples ingresos hospitalarios y una morbilidad alta.
- No obstante, como el TxC es una intervención rara, son pocos los protocolos e información disponibles sobre cómo hacer el seguimiento de los posibles rechazos (la actividad más común desplegada en la sala de hemodinámica).
¿QUÉ APORTA DE NUEVO?
- Se llevó a cabo un análisis detallado de la actividad desplegada en la unidad de cardiología intervencionista pediátrica de un centro terciario de referencia. En líneas generales, las intervenciones más habituales fueron los cateterismos diagnósticos para el seguimiento de los rechazos. Las técnicas intervencionistas terapéuticas más habituales fueron las angioplastias con balón en vena cava superior y arterias pulmonares.
- Los pacientes con fisiología univentricular precisaron más CC post-TxC, si bien no se hallaron diferencias para otras CAC, así como tampoco en función de la edad, el peso u hospitalizaciones más largas en unidades de cuidados intensivos.
- Es necesario unificar protocolos en todos los centros.
CONSIDERACIONES ÉTICAS
Este trabajo fue aprobado por el comité de ética local, con una exención del formulario de consentimiento informado debido a su metodología retrospectiva. Se siguieron los principios establecidos en la Declaración de Helsinki en todo el estudio. A pesar de que los autores siguieron las directrices SAGER, debido a la naturaleza retrospectiva de este estudio y su realización en una población pediátrica, el género se documentó en con arreglo al sexo asigna- do al nacer tal y como aparece en la historia clínica de cada paciente.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se han empleado herramientas de inteligencia artificial en la elaboración de este estudio.
CONTRIBUCIÓN DE LOS AUTORES
A. Freixa-Benavente realizó la recopilación de datos, el análisis de resultados y la redacción del manuscrito. P. Dolader y F. Gran idearon el estudio, proporcionaron asesoramiento y revisaron el manuscrito. P. Betrián-Blasco lideró el proyecto, hizo la propuesta inicial, concibió la hipótesis original, dirigió la investigación y revisó y aprobó tanto el manuscrito como el análisis de este.
CONFLICTO DE INTERESES
P. Betrián es asesor personal de dispositivos para Occlutech no asociados a este trabajo. No se declaró ningún otro conflicto de intereres.
BIBLIOGRAFÍA
1. Chen S, Dykes JC, McElhinney DB, et al. Haemodynamic profiles of children with end-stage heart failure. Eur Heart J. 2017;38:2900-2909.
2. Morchi GS, Pietra B, Boucek MM, et Chan KC. Interventional cardiac catheterization procedures in pediatric cardiac transplant patients:Transplant surgery is not the end of the road. Catheter Cardiovasc Interventions. 2008;72:831-836.
3. Miyamoto SD, Pietra BA, Chan KC, et al. Long-term outcome of palliation with internal pulmonary artery bands after primary heart transplantation for hypoplastic left heart syndrome. Pediatr Cardiol. 2009;30:419-425.
4. Jeewa A, Chin C, Pahl E, et al. Outcomes after percutaneous coronary artery revascularization procedures for cardiac allograft vasculopathy in pediatric heart transplant recipients:A multi-institutional study. J Heart Lung Transplant. 2015;34:1163-1168.
5. Dipchand AI. Current state of pediatric cardiac transplantation. Ann Cardiothorac Surg. 2018;7:31-55.
6. Daly KP, Marshall AC, Vincent JA, et al. Endomyocardial biopsy and selective coronary angiography are low-risk procedures in pediatric heart transplant recipients:Results of a multicenter experience. J Heart Lung Transplant. 2012;31:398-409.
7. Salavitabar A, Flyer JN, Torres AJ, et al. Transcatheter stenting of superior vena cava obstruction after pediatric heart transplantation:A single-center experience assessing risk factors and outcomes. Pediatr Transplant. 2018;22:e13267.
8. Lim HS, Hsich E, Shah KB. International Society of Heart and Lung Transplantation position statement on the role of right heart catheterization in the management of heart transplant recipients. J Heart Lung Transplant. 2019;38:235-238.
9. Molkentin JP, Nägele MP, Frank M, et al. Prognostic value of mean pulmonary artery pressure in the stable phase after heart transplantation. Eur J Cardiothorac Surg. 2017;52:775-780.
10. O'Byrne ML, Glatz AC, Faerber JA, et al. Interhospital Variation in the Costs of Pediatric/Congenital Cardiac Catheterization Laboratory Procedures:Analysis of Data From the Pediatric Health Information Systems Database. J Am Heart Assoc. 2019;8:e011543.
11. Raissadati A, Pihkala J, Jahnukainen T, Jokinen E, Jalanko H, Sairanen H. Late outcome after paediatric heart transplantation in Finland. Interact Cardiovasc Thorac Surg. 2016;23:18-25.
12. Wellnheofer E, Lehmkuhl H, Hiemann N, et al. Monocenter study of percutaneous coronary interventions in 154 cardiac transplant recipients with chronic allograft vasculopathy. J Heart Lung Transplant.2007;26:182-183.
13. Sachdeva R, Seib PM, Burns SA, Fontenot EE, Frazier EA. Stenting for superior vena cava obstruction in pediatric heart transplant recipients. CatheterCardiovasc Interv. 2007;70:888-892.
14. Tadros HJ, Whelihan JT, Lopez-Colon D, et al. Risk factors associated with post-transplant superior caval vein stenosis in paediatric heart transplantation. Cardiol Young. 2021;31:1589-1594.
15. Jeewa A, Chin C, Pahl E, et al. Outcomes after percutaneous coronary artery revascularization procedures for cardiac allograft vasculopathy in pediatric heart transplant recipients:A multi-institutional study. J Heart Lung Transplant. 2015;34:1163-1168.
* Autor para correspondencia.
Correo electrónico: afreixbe11@gmail.com (A. Freixa-Benavente).