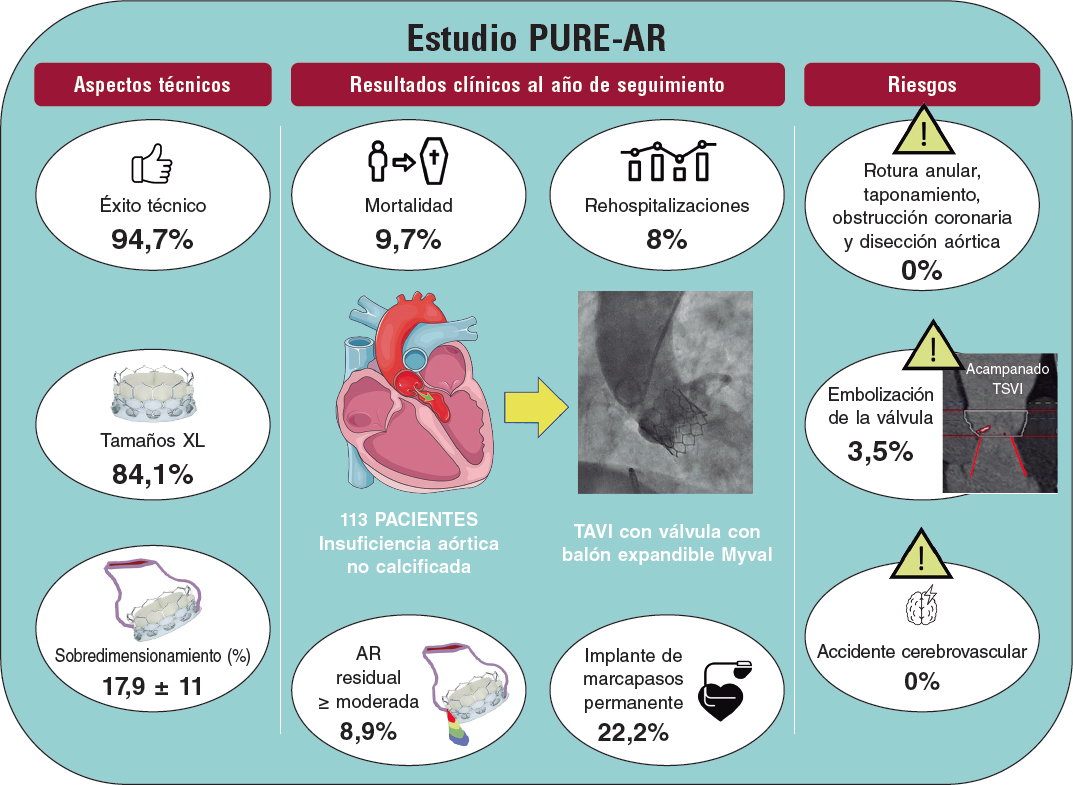
Sr. Editor:
El implante percutáneo de válvula aórtica (TAVI) puede ocasionar trastornos de la conducción importantes debido a la compresión mecánica producida por la válvula cardiaca percutánea, al haber cercanía entre el anillo aórtico, el nodo auriculoventricular y el septo membranoso (SM) del tracto de salida del ventrículo izquierdo. La incidencia de implante de marcapasos tras un TAVI es del 4-33%1.
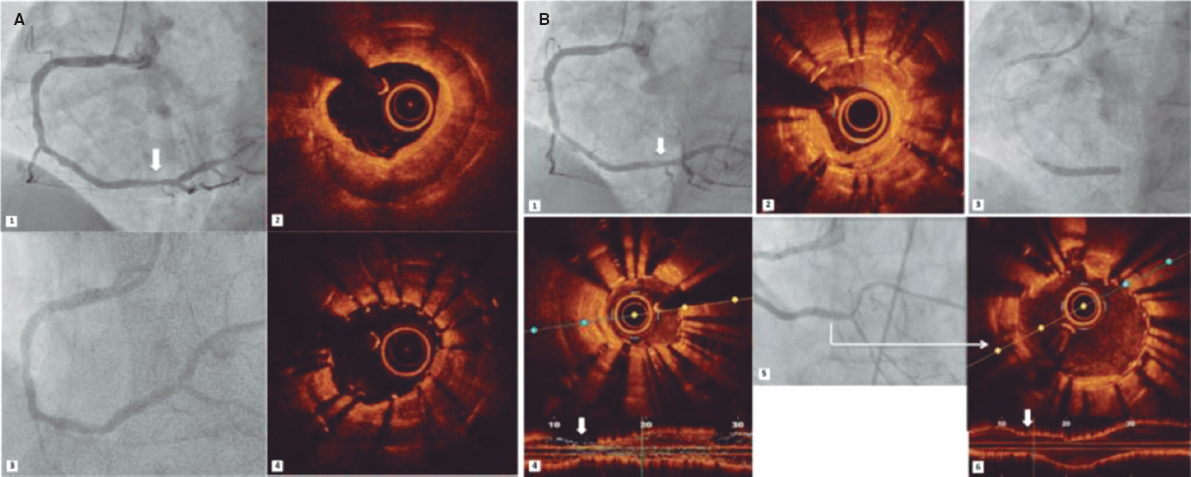
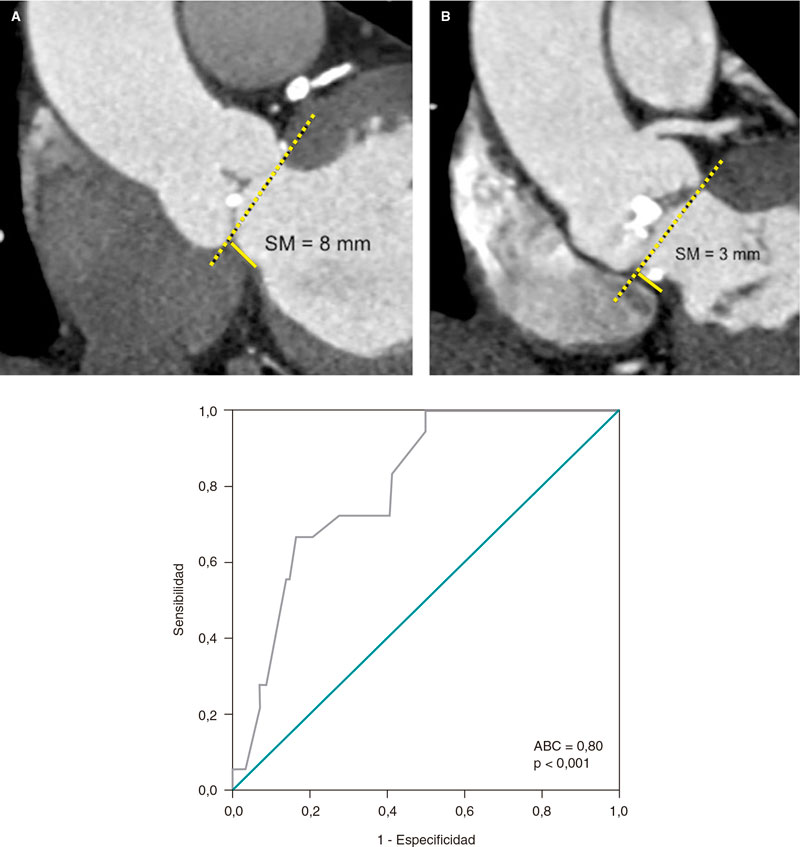
Se realizó un estudio retrospectivo y analítico de pacientes sintomáticos con estenosis aórtica grave, enviados a tomografía computarizada multidetector para protocolo TAVI entre diciembre de 2012 y octubre de 2022. Todos los pacientes firmaron el consentimiento informado antes de la tomografía obteniendo la aprobación para la realización del estudio. Se excluyeron pacientes con válvula aórtica bicúspide, portadores de marcapasos y pacientes con previa bioprótesis valvular quirúrgica. Nuestro objetivo fue demostrar si la longitud del SM se relaciona con la necesidad de implante de marcapasos tras el TAVI. Para medir la longitud del SM se consideró la distancia máxima desde el plano del anillo aórtico hasta la parte superior de la porción muscular del septo interventricular en la vista coronal, en la fase sistólica (figura 1A,B)2.
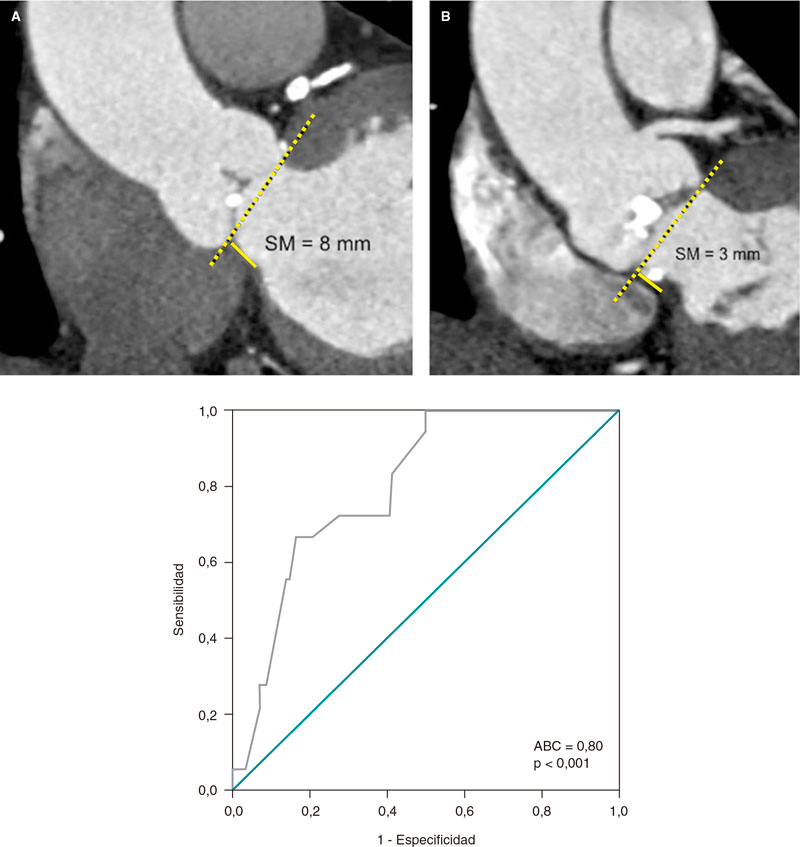
Figura 1. Medida de la longitud del septo membranoso (SM) por tomografía computarizada multidetector en vista coronal. A: paciente con SM de 8 mm, que no requirió marcapasos. B: paciente con SM de 3 mm y calcificación en el tracto de salida del ventrículo izquierdo, a quien se implantó un marcapasos por bloqueo auriculoventricular de tercer grado tras el implante percutáneo de válvula aórtica. C: curva ROC (receiver operating characteristic). Longitud del septo membranoso como predictor de implante de marcapasos. El área bajo la curva (ABC) es 0,80, con un punto de corte de 5,5 mm, una sensibilidad de 0,67 y una especificidad de 0,84 (p < 0,001).
Se utilizó la prueba de χ² o el test exacto de Fisher para las variables cualitativas y la prueba U de Mann-Whitney para las varia-bles cuantitativas. Se consideró estadísticamente significativo un valor de p < 0,005. Se construyó una curva ROC (receiver operating characteristic) para medir la precisión predictiva de la longitud del SM en relación con el implante de marcapasos. Los datos se analizaron con el programa IBM SPSS versión 26 (Estados Unidos).
Se evaluaron 134 pacientes consecutivos, de los cuales 71 (53%) eran varones y la edad media de 75,5 ± 7,6 años.
En el electrocardiograma previo al TAVI, 117 (87,3%) presentaban ritmo sinusal, 14 (10,4%) fibrilación auricular y 34 (25,4%) trastornos de la conducción (tabla 1).
Tabla 1. Características clínicas y electrocardiográficas antes y después del implante percutáneo de válvula aórtica (TAVI), parámetros tomográficos, tipos de válvula cardiaca percutánea y complicaciones tras el TAVI
| Variables | Total n = 134 | Marcapasos n = 18 | No marcapasos n = 116 | p |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad, años | 75,5 ± 7,6 | 76,2 ± 7,8 | 75,5 ± 7,5 | 0,63 |
| Sexo masculino, n (%) | 71 (53%) | 12 (66,7%) | 59 (51%) | 0,21 |
| IMC, kg/m2 | 26 ± 4,3 | 28 ± 6,8 | 25,7 ± 3,7 | 0,2 |
| Hipertensión, n (%) | 91 (67,9%) | 10 (55,6%) | 81 (69,8%) | 0,23 |
| Cardiopatía isquémica, n (%) | 74 (55,2%) | 9 (50%) | 65 (56%) | 0,63 |
| Diabetes mellitus, n (%) | 43 (32,1%) | 8 (44,4%) | 35 (30,2%) | 0,23 |
| Dislipidemia, n (%) | 36 (26,9%) | 5 (27,8%) | 31 (26,7%) | 1 |
| Tabaquismo, n (%) | 33 (24,6%) | 3 (16,7%) | 30 (25,9%) | 0,56 |
| Enfermedad renal, n (%) | 18 (13,4%) | 3 (16,7%) | 15 (12,9%) | 0,71 |
| Características electrográficas previas al TAVI | ||||
| Ritmo | ||||
| Sinusal, n (%) | 117 (87,3%) | 17 (94,4%) | 100 (86,2%) | 0,47 |
| Fibrilación auricular, n (%) | 14 (10,4%) | 0 | 14 (12,1%) | 0,21 |
| Aleteo, n (%) | 3 (2,2%) | 1 (5,6%) | 2 (1,7%) | 0,35 |
| Trastorno de conducción | ||||
| BRD, n (%) | 13 (9,7%) | 4 (22,2%) | 9 (7,8%) | 0,07 |
| BRI, n (%) | 10 (7,5%) | 2 (11,1%) | 8 (6,9%) | 0,66 |
| BAV primer grado, n (%) | 8 (5,9%) | 3 (16,7%) | 5 (4,3%) | 0,13 |
| BRI + BAV primer grado, n (%) | 2 (1,5%) | 0 | 2 (1,7%) | 1 |
| Bloqueo incompleto de rama izquierda, n (%) | 1 (0,7%) | 0 | 1 (0,9%) | 1 |
| Parámetros tomográficos | ||||
| Longitud del SM, mm | 6,86 ± 1,72 | 5,3 ± 1,2 | 7,1 ± 1,7 | < 0,001 |
| Presencia de calcificación de TSVI, n (%) | 39 (29,1%) | 9 (50%) | 30 (25,9%) | 0,036 |
| Tipo de válvula cardiaca percutánea | ||||
| Expandible con balón | ||||
| Edwards SAPIEN 3, n (%) | 60 (44,8%) | 8 (44,4%) | 52 (44,8%) | 0,9 |
| Edwards SAPIEN, n (%) | 14 (10,4%) | 3 (16,7%) | 11 (9,5%) | 0,4 |
| Edwards SAPIEN XT, n (%) | 8 (6%) | 1 (5,6%) | 7 (6%) | 1 |
| Autoexpandible | ||||
| Evolut R, n (%) | 17 (12,7%) | 1 (5,6%) | 16 (13,8%) | 0,47 |
| ACURATE neo, n (%) | 14 (10,4%) | 0 | 14 (12,1%) | 0,21 |
| Portico, n (%) | 11 (8,2%) | 1 (5,6%) | 10 (8,6%) | 1 |
| CoreValve, n (%) | 10 (7,5%) | 4 (22,2%) | 6 (5,2%) | 0,029 |
| Características electrocardiográficas pos-TAVI | ||||
| BAV tercer grado, n (%) | 16 (11,9%) | 16 (88,9%) | 0 | < 0,001 |
| BRI persistente de nueva aparición aislada, n (%) | 10 (7,4%) | 0 | 10 (8,6%) | 0,5 |
| BRI persistente + FA + TVNS, n (%) | 1 (0,8%) | 1 (5,6%) | 0 | 0,13 |
| BRI persistente + ritmo nodal, n (%) | 1 (0,8%) | 1 (5,6%) | 0 | 0,13 |
| BAV tercer grado transitorio, n (%) | 8 (6%) | 0 | 8 (6,9%) | 0,65 |
| BAV primer grado nuevo, n (%) | 6 (4,5%) | 0 | 6 (5,2%) | 0,41 |
| BRI transitorio, n (%) | 4 (3%) | 0 | 4 (3,4%) | 0,56 |
| FA aislada, n (%) | 2 (1,5%) | 0 | 2 (1,7%) | 0,75 |
| Ritmo nodal transitorio, n (%) | 1 (0,8%) | 0 | 1 (0,9%) | 0,87 |
| Aleteo, n (%) | 1 (0,8%) | 0 | 1 (0,9%) | 0,87 |
| Complicaciones tras el TAVI | ||||
| Locales: disección arteria iliaca o femoral, hematoma | 8 (6%) | 0 | 8 (6,9%) | 0,30 |
| Derrame pericárdico/taponamiento | 3 (2,2%) | 1 (5,6%) | 2 (1,7%) | 0,35 |
| ACV isquémico | 3 (2,2%) | 0 | 3 (2,6%) | 0,35 |
| Insuficiencia renal | 3 (2,2%) | 1 (5,6%) | 2 (1,7%) | 0,35 |
| Mortalidad intraprocedimiento | 5 (3,73%) | |||
| ACV isquémico extenso | 1 (0,.8%) | 0 | 1 (0,9%) | 0,86 |
| Shock hipovolémico por perforación de arteria iliaca | 1 (0,8%) | 0 | 1 (0,9%) | 0,86 |
| Shock cardiogénico por infarto agudo de miocardio | 3 (2,2%) | 0 | 3 (2,6%) | 0,65 |
| Mortalidad extrahospitalaria > 30 días tras el TAVI | ||||
| Etiología no cardiaca | 4 (2,98%) | 0 | 4 (3,4%) | 0,55 |
ACV: accidente cerebrovascular; BAV: bloqueo auriculoventricular; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FA: fibrilación auricular; IMC: índice de masa corporal; SM: septo membranoso; TAVI: implante percutáneo de válvula aórtica; TSVI: tracto de salida del ventrículo izquierdo; TVNS: taquicardia ventricular no sostenida. | ||||
La válvula expandible con balón más utilizada fue la Edwards SAPIEN (Edwards Lifesciences, Estados Unidos) 3, en 60 (44,8%) pacientes, y la autoexpandible más utilizada fue la Evolut R (Medtronic, Estados Unidos), en 17 (12,7%) (tabla 1).
Posterior al TAVI, presentaron bloqueo auriculoventricular de tercer grado 16 (11,9%) pacientes y bloqueo de rama izquierda persistente nuevo 12 (9%) pacientes (tabla 1).
Se implantó un marcapasos a 18/134 (13,4%). De ellos, 12/82 (14,6%) correspondían a válvula expandible con balón y 6/52 (11,5%) a válvula autoexpandible, con una relación significativa entre CoreValve (Medtronic, Estados Unidos) e implante de marcapasos (odds ratio [OR] = 5,24; intervalo de confianza del 95% [IC95%], 1,32-20,86; p = 0,029).
Nuestra población mexicana tenía un índice de masa corporal (IMC) de 26 kg/m2 y una longitud del SM de 6,86 mm. En los pacientes que recibieron marcapasos (n = 18), la longitud del SM fue significativamente menor (5,3 ± 1,2 frente a 7,1 ± 1,7 mm; p < 0,001), con un punto de corte de 5,5 mm (p < 0,001) (figura 1C). En el análisis univariante de longitud del SM < 5,5 mm y necesidad de implante de marcapasos, la OR fue de 6,80 (IC95%, 2,36-19,58).
Las medidas del SM pueden variar. En la literatura se encuentra, en población japonesa con un IMC de 21,7 kg/m2, una longitud del SM de 6,6 mm, siendo en pacientes con marcapasos de 5,3 ± 1,3 frente a 6,6 ± 1,4 mm (p < 0,001)3, mientras que en norteamericanos con un IMC de 28 kg/m2 se ha reportado una longitud del SM de 7,5 mm, siendo en pacientes con marcapasos de 6,4 ± 1,7 frente a 7,7 ± 1,9 mm (p < 0,001)4.
El bloqueo de rama derecha preexistente es un factor de riesgo de bloqueo auriculoventricular de alto grado. De los 13 pacientes con bloqueo de rama derecha previo, a 4 (22,2%) se les implantó marcapasos (p = 0,07). La media de la longitud del SM fue de 7,22 mm; en los 4 pacientes con marcapasos fue de 5,78 mm y en los otros fue de 7,86 mm (p = 0,063).
Hubo 10 pacientes con bloqueo de rama izquierda de base, con una longitud del SM promedio de 5,85 mm; en los 2 pacientes que recibieron marcapasos la media fue de 4,8 mm, y en los que no reci-bieron marcapasos fue de 6,11 mm (p = 0,3).
Se encontró una asociación significativa de la calcificación del tracto de salida del ventrículo izquierdo tanto con implante de marcapasos (OR = 2,86; IC95%, 1,04-7,89; p = 0,036) como con trastornos de la conducción (OR = 2,65; IC95%, 1,22-5,72; p = 0,012).
De los 14 pacientes con fibrilación auricular previa, a ninguno se le implantó marcapasos. Mentias et al.5 encontraron que la incidencia de implante de marcapasos fue significativamente menor (p < 0,001) en los pacientes con fibrilación auricular preexistente (24,9%) en comparación con aquellos con ritmo sinusal basal (25,3%) y fibrilación auricular nueva (28,2%).
La incidencia de bloqueo de rama izquierda de nueva aparición tras el TAVI es del 8-30% con válvulas expandibles con balón y del 22-50% con válvulas autoexpandibles como CoreValve2. Se encuentra una incidencia menor, del 9% (12/134), siendo 5/82 (6,1%) pacientes con válvula expandible con balón y 7/52 (13,5%) con válvula autoexpandible. Sammour et al.6 demostraron que la profundidad de implante de la válvula cardiaca percutánea es un predictor de bloqueo de rama izquierda nuevo. Una limitación de nuestro estudio es que no se midió la altura de implante de la válvula. Otras limitaciones fueron la muestra pequeña y de un solo hospital, y la falta de medición del grado de sobreexpansión del anillo.
Se concluye que la longitud del SM y la calcificación del tracto de salida del ventrículo izquierdo evaluados por tomografía computarizada multidetector son importantes predictores de necesidad de implante de marcapasos.
FINANCIACIÓN
Sin financiación.
CONSIDERACIONES ÉTICAS
Por la naturaleza de este estudio de carácter observacional, retrospectivo, unicéntrico y sin intervención de ningún tipo, no se consideró necesaria su aprobación por el Comité Ético ni los consentimientos informados una vez garantizada la anonimidad de la información. La decisión de realizarse la tomografía fue a discreción del médico tratante. De acuerdo con las directrices SAGER, se consideraron las variables de sexo y género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se utilizaron herramientas de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORES
D.I. Katekaru-Tokeshi ideó el trabajo, realizó la recolección de datos y su análisis, y redactó el texto. H.A. Ale-Gonzáles recolectó y analizó los datos, y contribuyó a la redacción del manuscrito. P. Custodio-Sánchez analizó los datos y revisó el manuscrito. M. Jiménez-Santos interpretó los estudios de tomografía computarizada y revisó el manuscrito. E. Kimura-Hayama revisó el manuscrito y las imágenes. F. Castillo-Castellón interpretó los estudios de tomografía computarizada e hizo una revisión crítica del artículo. Todos los autores aprobaron la versión final del texto.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Muñoz-García AJ, Muñoz-García E, Alonso-Briales JH, Hernández-García JM. Trastornos de la conducción auriculoventricular tras el implante valvular aórtico transcatéter. Rev Esp Cardiol Supl. 2015;15(C):44-48.
2. Hamdan A, Guetta V, Klempfner R, et al. Inverse relationship between membranous septal length and the risk of atrioventricular block in patients undergoing transcatheter aortic valve implantation. J Am Coll Cardiol Intv. 2015;8:1218-1228.
3. Miki T, Senoo K, Ohkura T, et al. Importance of Preoperative Computed Tomography Assessment of the Membranous Septal Anatomy in Patients Undergoing Transcatheter Aortic Valve Replacement With a Balloon-
Expandable Valve. Circ J. 2020;84:269-276.
4. Maeno Y, Abramowitz Y, Kawamori H, et al. A highly predictive risk model for pacemaker implantation after TAVR. JACC Cardiovasc Imaging. 2017;
10:1139-1147.
5. Mentias A, Saad M, Girotra S, et al. Impact of Pre-Existing and New-Onset Atrial Fibrillation on Outcomes After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol Intv. 2019;12:2119-2129.
6. Sammour Y, Lak H, Chahine J, et al. Clinical and echocardiographic outcomes with new-onset left bundle branch block after SAPIEN-3 transcatheter aortic valve replacement. Catheter Cardiovasc Interv. 2023;101:187-196.
* Autor para correspondencia.
Correo electrónico: diakatekaru@hotmail.com (D.I. Katekaru-Tokeshi).