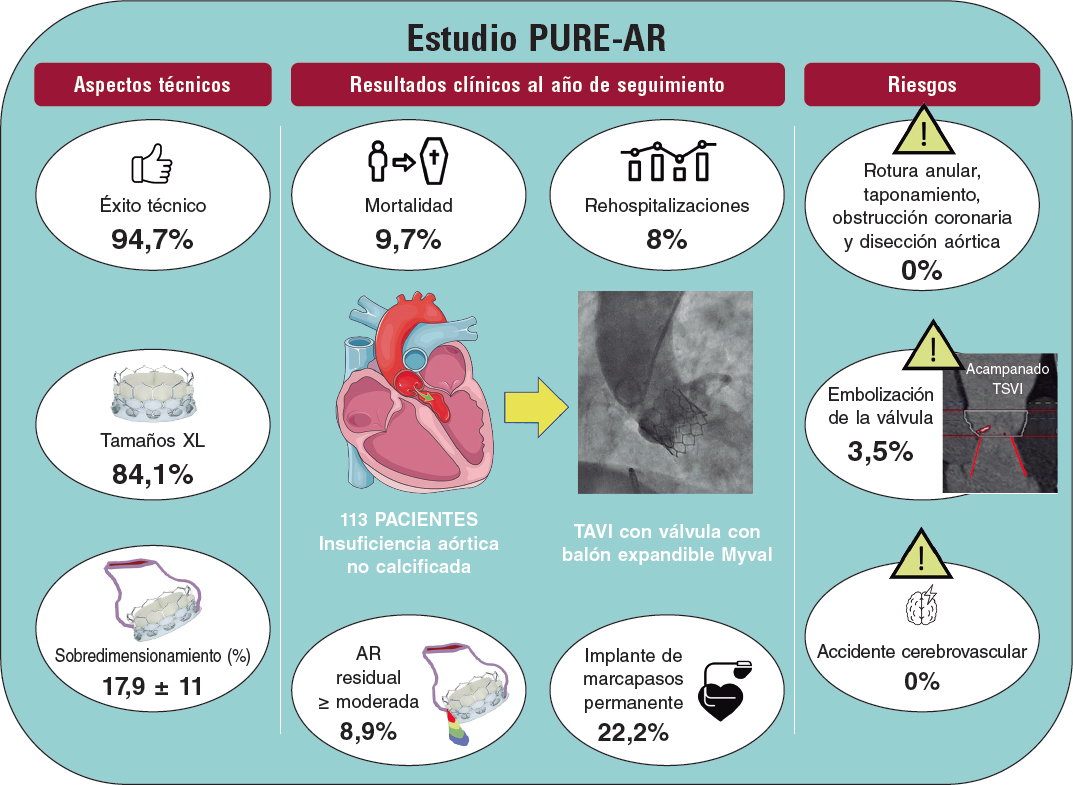
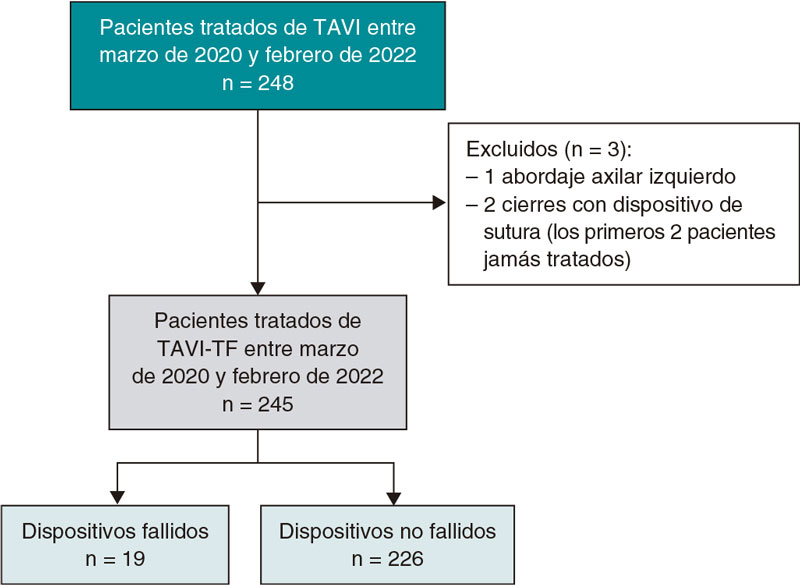
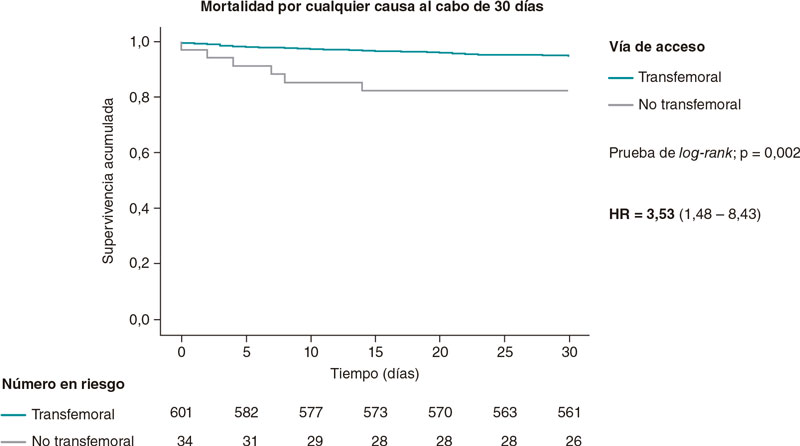
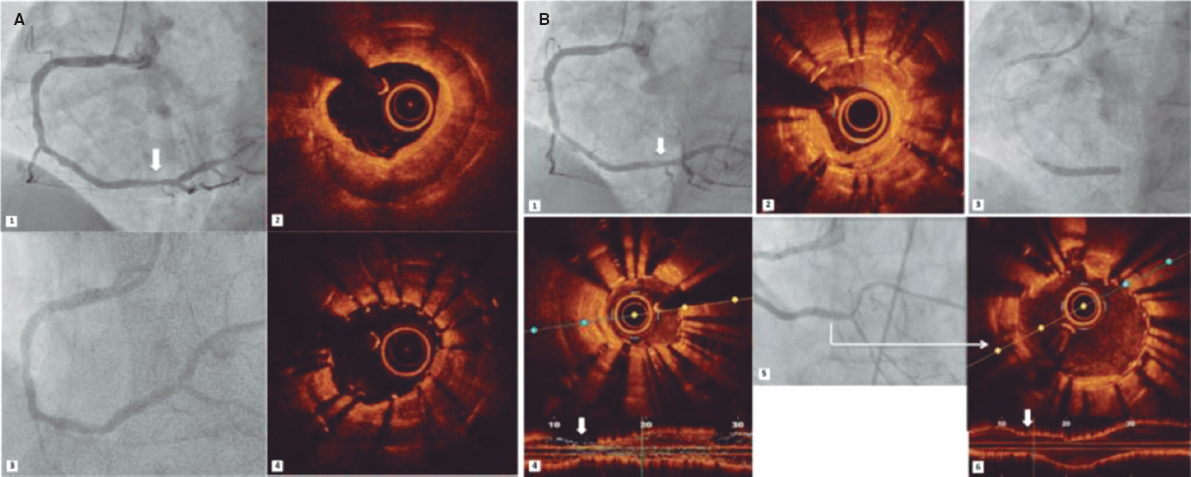
La estenosis valvular aórtica es una de las enfermedades cardiovasculares más agudas y crónicas que existen. La válvula aórtica bicúspide es la anomalía cardiaca congénita más frecuente y las personas afectadas tienen un 50% de probabilidades de desarrollar estenosis grave de la válvula aórtica a lo largo de la vida. En la valvulopatía aórtica (tanto la estenosis valvular aórtica como la válvula aórtica bicúspide), las válvulas cardiacas están dañadas y no funcionan adecuadamente. Se trata de una patología que puede deteriorar rápidamente la acción de bombeo del corazón y degenerar en insuficiencia cardiaca, una enfermedad que afecta a casi 26 millones de personas en todo el mundo y cuya prevalencia y morbimortalidad van en aumento1. Aquí lo más relevante es que la valvulopatía aórtica suele coexistir con otras cardiopatías, dando lugar al escenario más general pero también más desafiante: valvulopatías, ventriculopatías y patologías vasculares complejas (C3VD). En las C3VD son muchas las valvulopatías, ventriculopatías y patologías vasculares que interactúan entre sí al tiempo que los fenómenos físicos asociados a cada cardiopatía amplifican los efectos de las demás sobre el sistema cardiovascular.
El análisis de la relación presión-volumen (P-V) en el ventrículo izquierdo (VI) es una potente herramienta para valorar la mecánica cardiaca. Este análisis puede revelar los mecanismos fisiopatológicos que subyacen en la insuficiencia cardiaca, incluida la insuficiencia cardiaca con fracción de eyección mantenida, las miocardiopatías y las valvulopatías. En este sentido, resulta esencial en la valoración y manejo tanto de la insuficiencia cardiaca como de las valvulopatías y también contribuye a explicar los efectos a corto y largo plazo de las intervenciones valvulares y de otro tipo con implicaciones cardiacas. Además, el análisis de la relación P-V del VI se puede emplear para hacer seguimiento de los efectos cardiacos de dispositivos médicos relacionados, soporte mecánico cardiaco, intervenciones terapéuticas y fármacos2-5. De hecho, el análisis de la relación P-V del VI tiene un potencial excepcional para incorporarse a la práctica clínica actual y hacer avanzar el tratamiento estándar.
La valvulopatía aórtica aumenta la presión del VI, la presión diastólica final del VI, la carga de trabajo del VI, la rigidez del sistema arterial sistémico y la poscarga del VI, lo cual contribuye tanto a la disfunción sistólica como diastólica del VI6, una causa importante de la insuficiencia cardiaca de estos pacientes. Aunque el implante percutáneo de válvula aórtica (TAVI) ofrece resultados positivos y ha reducido drásticamente la tasa de mortalidad, esta intervención fracasa en el 25-35% de los pacientes (que fallecen o no recuperan una calidad de vida razonable tras la intervención)7. De hecho, todavía no se entienden del todo los cambios hemodinámicos intraoperatorios inmediatos y longitudinales que sobrevienen e influyen en el sistema aórtico-ventricular izquierdo tras el reemplazo de la válvula aórtica. Aunque el TAVI reduce el gradiente de presión transvalvular, mejora la función sistólica y diastólica del VI a largo plazo. A pesar de los beneficios observados, el análisis invasivo de la relación P-V del VI reveló una función sistólica y diastólica del VI deteriorada en la fase temprana tras el TAVI6-8. El análisis de la relación P-V del VI también reveló una insuficiencia cardiaca aguda a pesar de los TAVI realizados con éxito en muchos pacientes5,9. De hecho, el análisis de la relación P-V del VI aclaró que los descensos del gradiente de presión transvalvular post-TAVI no siempre se acompañaron de mejoras en la carga de trabajo del VI. Ha quedado demostrado que aunque el TAVI no influye en la carga de trabajo del VI en muchos pacientes, la carga de trabajo del VI post-TAVI aumentó significativamente en algunos2,5,10.
En contextos clínicos, el cateterismo cardiaco es el patrón oro para calcular la presión y el flujo a través del corazón para analizar la relación P-V del VI. No obstante, debido a su naturaleza invasiva, coste y riesgos, no es práctico a efectos diagnósticos en aplicaciones clínicas de la práctica diaria ni en exploraciones de seguimiento seriadas. Lo más importante es que el cateterismo cardiaco solo da acceso a la presión arterial en regiones muy limitadas sin dar detalles del flujo fisiológico ni las presiones en todo el corazón o el sistema circulatorio. Tampoco existe ningún método, invasivo o no, para cuantificar la carga de trabajo cardiaco, y saber cuál es la contribución de cada componente de las enfermedades cardiovasculares. Esto es importantísimo en presencia de TAVI y C3VD, donde tanto la cuantificación de la carga de trabajo del ventrículo izquierdo como su desglose son importantes para guiar la prioridad de las intervenciones. Tampoco existe un método no invasivo para determinar la presión diastólica final del VI, la presión instantánea del VI o la contractilidad. Todos estos parámetros nos dan información valiosa sobre el deterioro cardiaco del paciente y la recuperación del corazón.
Keshavarz-Motamed11,12 desarrolló la primera y única herramienta predictiva no invasiva para el diagnóstico y seguimiento específicos del paciente basada en Doppler capaz de investigar y cuantificar los efectos de intervenciones, fármacos y constituyentes de las C3VD sobre la función cardiaca y el sistema circulatorio sin riesgo para el paciente (figura 1).
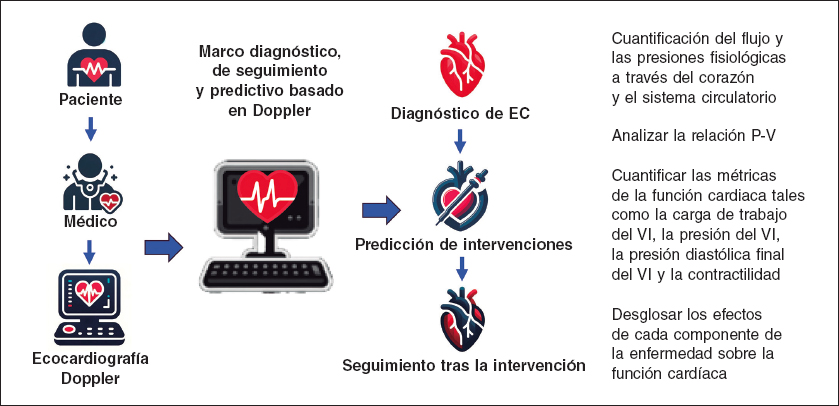
Figura 1. Diagrama de flujo de la herramienta diagnóstica, predictiva y de seguimiento basada en Doppler específica para cada paciente. La herramienta utiliza algunos parámetros de entrada que se pueden medir de manera simple y confiable mediante ecocardiografía Doppler. Esta nueva herramienta4,10-15 fue validada mediante cateterismo cardiaco y RM con flujo 4D en pacientes con C3VD (hasta ahora ~ n = 600) con una variabilidad importante entre e intra-pacientes y una amplia gama de enfermedades cardiovasculares (tanto en adultos como congénitas). 4D: tetradimensional; C3VD: valvulopatías, ventriculopatías y patologías vasculares complejas; EC: enfermedad cardiovascular; RM: resonancia magnética; VI: ventrículo izquierdo.
Este novedoso método4,10,15 tiene varias capacidades que resultan clave (figura 2, resultados de muestra): a) cuantifica los detalles del flujo pulsátil fisiológico y las presiones a través del corazón y el sistema circulatorio; b) hace seguimiento de los estados cardiaco y vascular en base a modelos precisos que varían en función del tiempo y reproducen respuestas fisiológicas; c) analiza la relación P-V del VI y cuantifica métricas de la función cardiaca, específicamente en términos de la carga de trabajo del corazón; d) desglosa los efectos de cada componente de la enfermedad en la función cardiaca global (por ejemplo, la carga de trabajo cardiaca) para ayudar a predecir los efectos de las intervenciones y planificar la secuencia de intervenciones en el manejo de las C3VD; e) cuantifica otras métricas de la función cardiaca como la presión diastólica final del VI, la presión instantánea del VI y la contractilidad. Ninguna de estas métricas se puede obtener de manera no invasiva en los pacientes y, cuando se realiza un cateterismo cardiaco invasivo, las métricas recopiladas tampoco son tan completas como las que el nuevo método es capaz de proporcionar. Aunque esta información es de vital importancia para el uso efectivo de terapias avanzadas para mejorar los resultados clínicos y guiar las intervenciones en los pacientes, en la actualidad, no están disponibles en contextos clínicos.
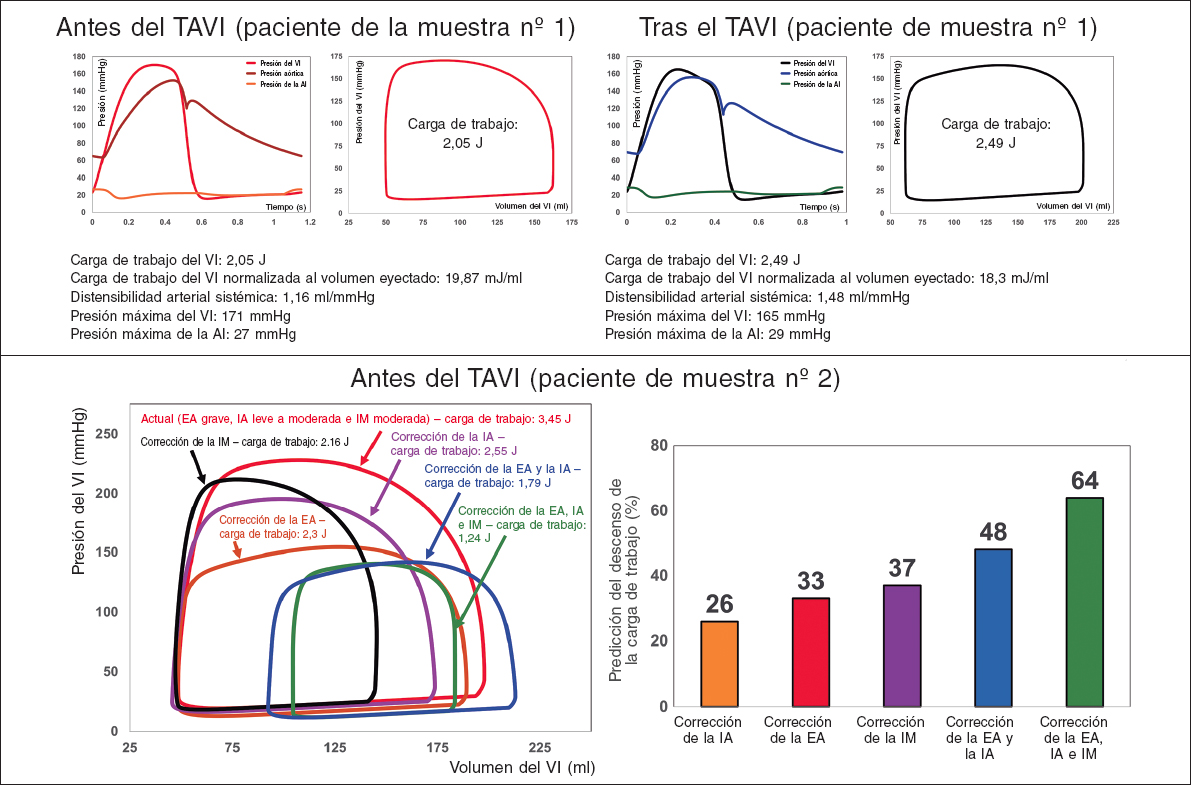
Figura 2. Diagnóstico y seguimiento del paciente muestra 1 desde el inicio hasta trascurridos 90 días: este paciente no se benefició completamente del implante percutáneo de válvula aórtica (TAVI). En lugar de mejorar el estado cardiaco del paciente reduciendo la carga de trabajo del VI, el TAVI aumentó dicha carga de trabajo. Ejemplo del análisis desglosado y predicción de la carga de trabajo a efectos de las intervenciones del paciente muestra 2: derecha: relaciones P-V del estado actual de la enfermedad y predicción de varias intervenciones valvulares. Izquierda: porcentaje de descenso previsto en la carga de trabajo del VI tras las intervenciones valvulares. Tanto la insuficiencia de la válvula mitral (aumento del 38%) como la estenosis e insuficiencia de la válvula aórtica (aumento del 48%) aumentaron, significativamente, la carga de trabajo. Este paciente solo fue tratado de TAVI. No obstante, teniendo en cuenta este cálculo, se debería haber valorado, también, la posibilidad de intervenir la válvula mitral cuando se intervino la válvula aórtica. AI: aurícula izquierda; EA: estenosis aórtica; IA: insuficiencia aórtica; IM: insuficiencia mitral; VI: ventrículo izquierdo. Se recibieron, retrospectivamente, los datos de pacientes de diferentes centros en los que se aprobó la exención del consentimiento informado y la transferencia de datos por parte de sus Juntas de Revisión Institucional.
CONCLUSIONES
El novedoso método desarrollado y verificado por Keshavarz-Motamed11,12 utiliza intencionadamente parámetros de entrada confiables y no invasivos medidos mediante ecocardiografía Doppler para calcular continuamente la hemodinámica específica del paciente que se empleará en el diagnóstico, seguimiento y predicción de la función cardiaca y el estado circulatorio. Este innovador método tiene aplicaciones potenciales: a) en ensayos clínicos, permitiendo el análisis no invasivo de métricas de la función cardiaca y circulatoria. b) como herramienta diagnóstica para analizar métricas de la función cardiaca de manera no invasiva en la atención rutinaria, ambulatoria o en unidades de cuidados intensivos y críticos. c) como herramienta para el seguimiento de pacientes con potencial de incorporarse a dispositivos personales «portatiles» y d) como módulo incorporado al software de los equipos de ecocardiografía Doppler para mejorar el diagnóstico y la predicción.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Savarese G, Lund LH. Global Public Health Burden of Heart Failure. Card Fail Rev. 2017;3:7-11.
2. Keshavarz-Motamed Z, Khodaei S, Rikhtegar Nezami F, et al. Mixed Valvular Disease Following Transcatheter Aortic Valve Replacement:Quantification and Systematic Differentiation Using Clinical Measurements and Image-Based Patient-Specific In Silico Modeling. J Am Heart Assoc. 2020;9:e015063.
3. Bastos MB, Burkhoff D, Maly J, et al. Invasive left ventricle pressure-volume analysis:overview and practical clinical implications. Eur Heart J. 2020;41:1286-1297.
4. Khodaei S, Abdelkhalek M, Maftoon N, Emadi A, Keshavarz-Motamed Z. Early Detection of Risk of Neo-Sinus Blood Stasis Post-Transcatheter Aortic Valve Replacement Using Personalized Hemodynamic Analysis. Struct Heart. 2023;7:100180.
5. Ben-Assa E, Brown J, Keshavarz-Motamed Z, et al. Ventricular stroke work and vascular impedance refine the characterization of patients with aortic stenosis. Sci Transl Med. 2019;11:eaaw0181.
6. Seppelt PC, De Rosa R, Mas-Peiro S, Zeiher AM, Vasa-Nicotera M. Early hemodynamic changes after transcatheter aortic valve implantation in patients with severe aortic stenosis measured by invasive pressure volume loop analysis. Cardiovasc Interv Ther. 2022;37:191-201.
7. Arnold SV. Calculating Risk for Poor Outcomes After Transcatheter Aortic Valve Replacement. J Clin Outcomes Manag. 2019;26:125-129.
8. Sarraf M, Burkhoff D, Brener MI. First-in-Man 4-Chamber Pressure-Volume Analysis During Transcatheter Aortic Valve Replacement for Bicuspid Aortic Valve Disease. JACC Case Rep. 2021;3:77-81.
9. Fischer-Rasokat U, Renker M, Liebetrau C, et al. Outcome of patients with heart failure after transcatheter aortic valve implantation. PLoS One. 2019;14:e0225473.
10. Khodaei S, Garber L, Abdelkhalek M, Maftoon N, Emadi A, Keshavarz?Motamed Z. Reducing Long?Term Mortality Post Transcatheter Aortic Valve Replacement Requires Systemic Differentiation of Patient?Specific Coronary Hemodynamics. Journal of the American Heart Association. 2023;12:e029310.
11. Keshavarz-Motamed Z. A diagnostic, monitoring, and predictive tool for patients with complex valvular, vascular and ventricular diseases. Sci Rep. 2020;10:1-19.
12. Keshavarz Motamed Z. Diagnostic, monitoring, and predictive tool for subjects with complex valvular, vascular and ventricular diseases. US &Canada patent US11844645B2, granted, 2023.
13. Bahadormanesh N, Tomka B, Kadem M, Khodaei S, Keshavarz-Motamed Z. An ultrasound-exclusive non-invasive computational diagnostic framework for personalized cardiology of aortic valve stenosis. Med Image Anal. 2023;87:102795.
14. Sadeghi R, Tomka B, Khodaei S, Garcia J, Ganame J, Keshavarz?Motamed Z. Reducing Morbidity and Mortality in Patients With Coarctation Requires Systematic Differentiation of Impacts of Mixed Valvular Disease on Coarctation Hemodynamics. J Am Heart Assoc. 2022;11:e022664.
15. Sadeghi R, Tomka B, Khodaei S, et al. Impact of extra-anatomical bypass on coarctation fluid dynamics using patient-specific lumped parameter and Lattice Boltzmann modeling. Sci Rep. 2022;12:9718.
* Autor para correspondencia.
Correo electrónico: motamedz@mcmaster.ca (Z. Keshavarz-Motamed).