INTRODUCCIÓN
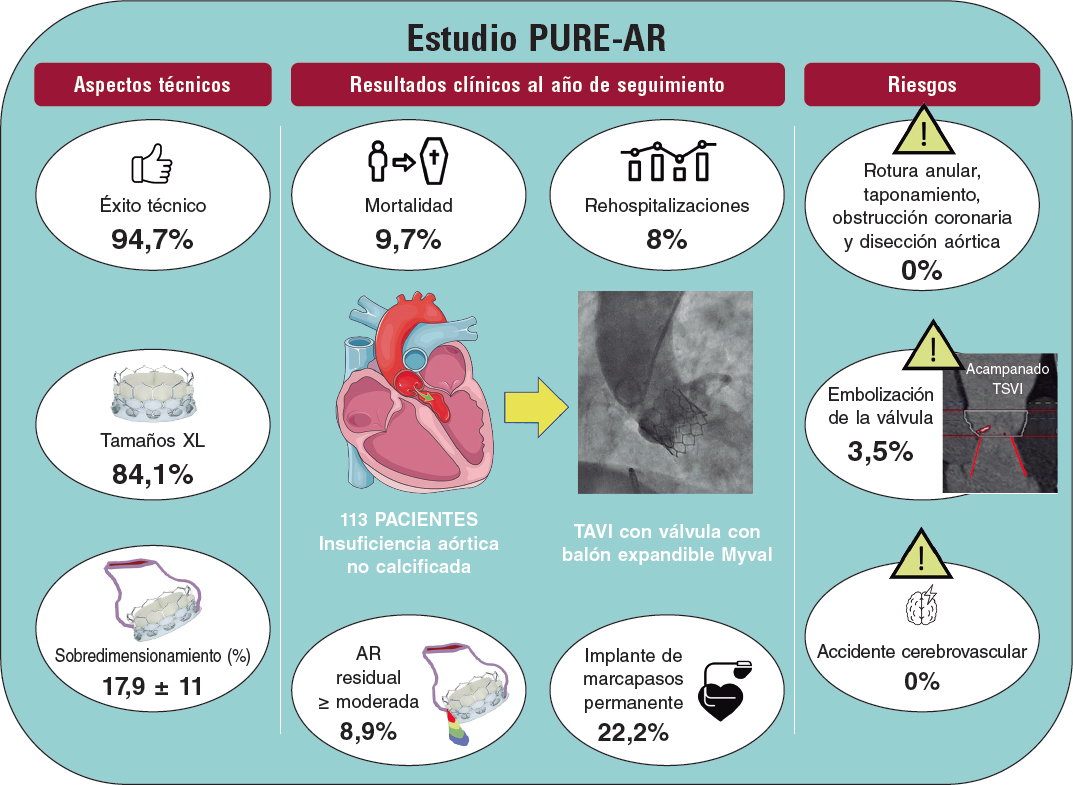
La patología del tracto de salida del ventrículo derecho (TSVD) es frecuente en niños y adultos con cardiopatías congénitas, a menudo como secuela tras una cirugía previa. En las últimas dos décadas, el implante percutáneo de prótesis pulmonares ha ido aumentando progresivamente, hasta el punto de que las guías actuales1 lo recomiendan como vía de elección en pacientes con conductos o bioprótesis previas. No obstante, muchos pacientes presentan tractos de salida nativos o reparados con parche (en adelante englobados como TSVD nativos), cuya lesión predominante es la insuficiencia pulmonar, en los que la valvulación percutánea es más compleja debido a la propia anatomía del TSVD, su comportamiento dinámico, las mayores dimensiones del anillo pulmonar y la inexistencia de una zona de anclaje adecuada para la válvula. Las diferencias en la cardiopatía de base, en la reparación quirúrgica previa y en la configuración de las arterias pulmonares hacen que el TSVD tenga una morfología muy variable, pudiéndose agrupar en 5 subtipos2 (figura 1).
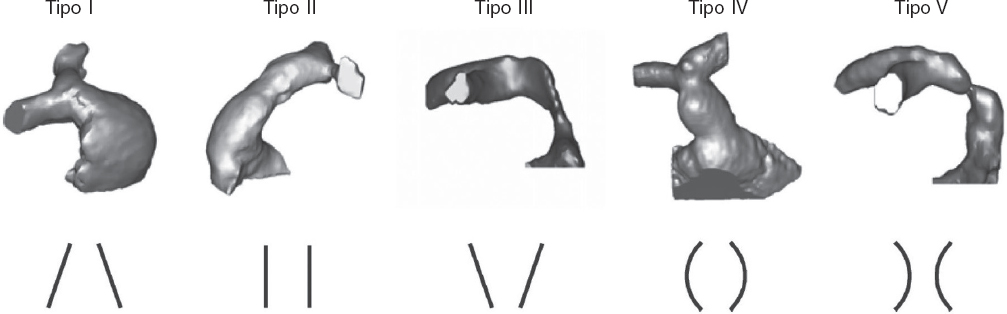
Figura 1. Cinco tipos de anatomía del TSVD nativo. I: piramidal; II: cilíndrico o tubular; III: piramidal inverso; IV: ensanchamiento central; V: estrechamiento central. (Reproducido de Schievano et al.2 con permiso de la autora).
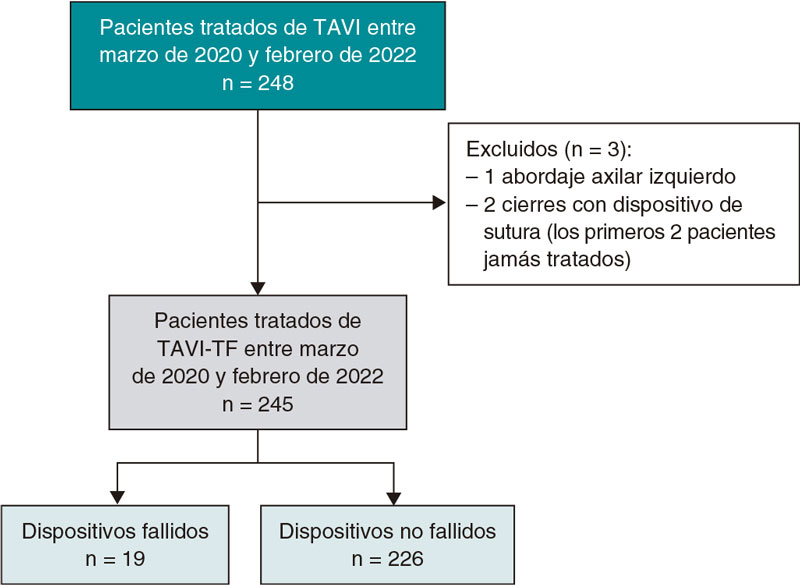
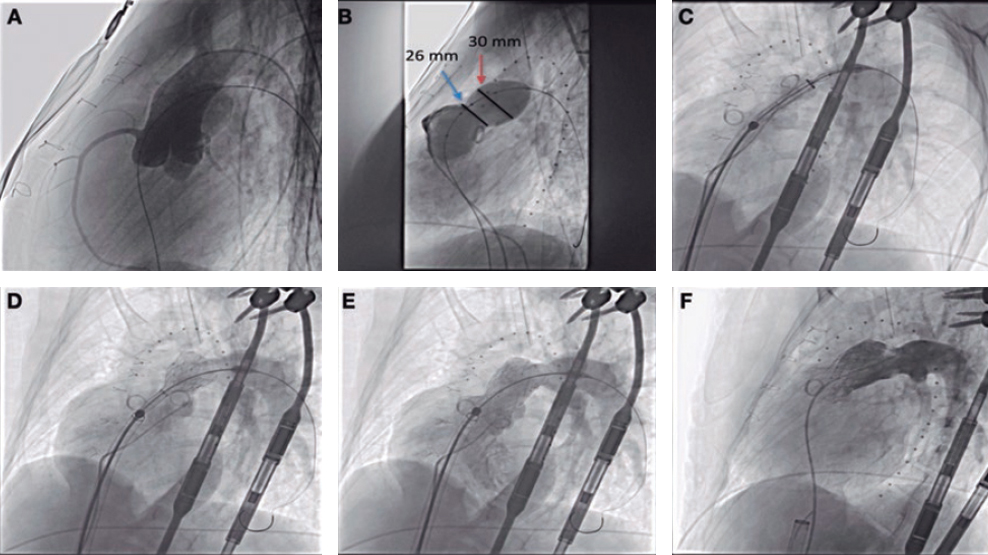
La tetralogía de Fallot reparada es el paradigma y en estos casos el estándar de tratamiento sigue siendo la cirugía. No obstante, el desarrollo de los procedimientos percutáneos ha hecho posible que cada vez más pacientes con estos sustratos puedan ser tratados de forma percutánea (figura 2).
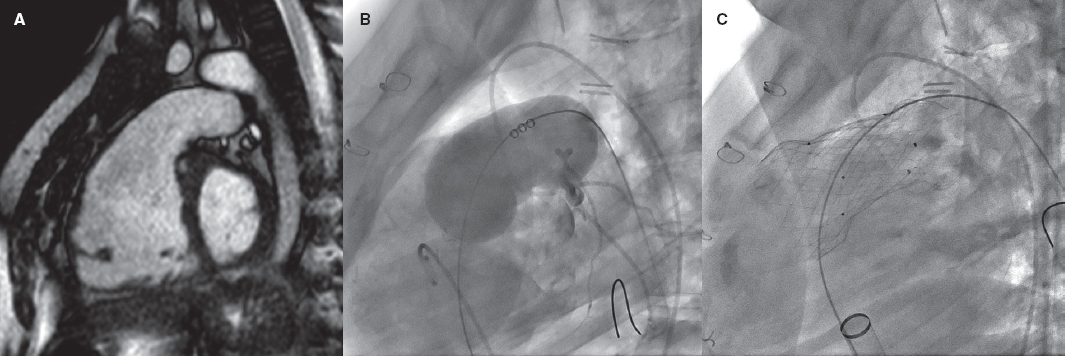
Figura 2. Implante de válvula pulmonar autoexpandible en un tracto de salida del ventrículo derecho (TSVD) aneurismático. A: TSVD gravemente dilatado en imagen de resonancia magnética, con aplanamiento del septo interventricular. B: test de tallado con balón en el TSVD con inyección simultánea en el tronco coronario izquierdo. C: prótesis Venus-P (MedTech, China) desplegada en el TSVD, con buen resultado.
Existen dos modelos de válvulas expandibles con balón autorizadas para el tratamiento de bioprótesis y conductos disfuncionantes: las prótesis Melody (Medtronic, Estados Unidos) y SAPIEN (modelo XT, Edwards Lifesciences, Estados Unidos). Aunque no se han autorizado para su implante en TSVD nativos, ambas (junto con la SAPIEN S3) se han utilizado en este escenario fuera de indicación.
Para hacer frente a las características particulares del TSVD nativo se han desarrollado varios modelos de válvulas autoexpandibles: Venus-P (Venus MedTech, China; con marca CE para su uso en Europa desde 2022), PULSTA (TaeWoong Medical, Corea del Sur) y Harmony (Medtronic, Estados Unidos, con autorización previa de la Food and Drug Administration). También se ha utilizado el dispositivo Alterra (Edwards Lifesciences), que funciona como pre-stent autoexpandible sobre el cual se implanta posteriormente una prótesis SAPIEN.
Las características de cada una de estas válvulas se han descrito en detalle en un número previo de REC: Interventional Cardiology3.
RESULTADOS DE LAS PRÓTESIS PERCUTÁNEAS EN EL TRACTO DE SALIDA DEL VENTRÍCULO DERECHO NATIVO
Cada vez se dispone de más información sobre los resultados favorables y la durabilidad de las válvulas percutáneas. El registro multicéntrico más grande hasta la fecha4 incluyó 2.476 pacientes (82% con Melody y 18% con SAPIEN, incluidos un 16% de TSVD nativos), con una supervivencia del 91,1% a los 8 años del implante y una tasa de reintervenciones del 25,1%, similar a la publicada en algunas series quirúrgicas5. Estudios comparativos no aleatorizados6 y un metanálisis reciente7 también han encontrado resultados equivalentes en cuanto a tasa de reintervención. Algunas series describen tasas más altas en pacientes con Melody en comparación con SAPIEN8,9, aunque los grupos no eran directamente comparables, con una supervivencia libre de reintervención en pacientes con SAPIEN similar a la de los portadores de válvulas quirúrgicas8.
La prótesis SAPIEN se puede implantar con o sin pre-stent, según las características del paciente, con buenos resultados. El mayor estudio incluyó 774 pacientes con los modelos XT y S310, de los cuales el 51% tenían TSVD nativos (tabla 1).
Tabla 1. Resumen de algunos de los principales estudios que han incluido pacientes con tracto de salida del ventrículo derecho nativo
| Autor y año | Pacientes con TSVD nativo/total pacientes | Tipo de válvula | Seguimiento | Éxito del implante | Otros resultados | Complicaciones |
|---|---|---|---|---|---|---|
| Malekzadeh-Milani et al.23, 2014 | 34/34 | Melody | 2,6 años | 100% | Fuga periprotésica en 2 pacientes en el seguimiento | 3 complicaciones agudas (9%): 1 hemoptisis, 1 obstrucción del TSVD, 1 embolización de stent |
| Meadows et al.18, 2014 | 31/31 | Melody | 15 meses (1 mes- 3,8 años) | 100% | Sin mortalidad ni insuficiencia protésica | Fracturas de stent 32%, asociándose a mayor tasa de estenosis. 3 casos de endocarditis. Reintervención en 3 pacientes |
| Garay et al.13, 2017 | 10/10 | Venus P | 12 meses (4-21) | 100% | Normofunción protésica, sin fracturas de stent, remodelado ventricular derecho y mejoría de la clase NYHA | Ninguna |
| Martin et al.11, 2018 | 132/132 | Melody | No seguimiento | Cohorte completa de 229 pacientes, pero implante solo en el 58%. Buen resultado hemodinámico inmediato | 4% complicaciones (casi todas por migración del stent) | |
| Morgan et al.24, 2019 | 41/57 | Sapien (S3, XT) | 5,3 meses (1-26) | 100% | Sin pre-stent. Normofunción protésica en seguimiento. Sin mortalidad | 1 compresión aórtica. 2 daño valvular tricúspide. 1 insuficiencia valvular |
| Shahanavaz et al.10, 2020 | 397/774 | Sapien S3 (78%) XT (22%) | 12 meses (n = 349) | 97,4% | Normofunción protésica: 91,5% | Eventos adversos: 10%. Cirugía urgente: 14 pacientes (1,8%). Daño tricúspide: 3% |
| Goldstein et al.19, 2020 | 143/530 | Melody (88%) Sapien (22%) | 1 año | Normofunción protésica: 98% | 1 muerte. 13,3% reintervenciones (la mayoría no relacionadas con la válvula) | |
| Lee et al.12, 2021 | 25/25 | Pulsta | 33 (± 14) meses | 100% | Sin casos de disfunción protésica | Sin eventos adversos significativos |
| Gillespie et al.16, 2021 | 21/21 | Harmony | 5 años | 100% | Implante en todos menos 1 paciente por hipertensión pulmonar. Normofunción protésica en los pacientes no reintervenidos | Explante de válvula en 2 casos. 1 muerte a los 3 años del implante. 2 reintervenciones (valve-in-valve) |
| Morgan et al.25, 2021 | 38/38 | Venus | 27 meses | 97,4% | Normofunción protésica en el seguimiento | Migración: 2 casos (cirugía en 1) |
| Houeijeh et al.9, 2023 | 99/214 | Sapien XT/S3 (85%) Melody (15%) | 2,8 años (3 meses-11,4 años) | Solo incluidos los casos con implante exitoso | Supervivencia libre de reintervención a 5-10 años del 78,1-50,4% (Melody) y del 94,3-82,2% (Sapien) | Complicaciones graves: 2,3%. 1 muerte relacionado con la válvula. Endocarditis 5,5/100 pacientes-año (Melody) y 0,2/100 pacientes-año (Sapien) |
| Álvarez et al.14, 2023 | 8/8 | Venus | Sin seguimiento | 100% | Normofunción protésica en todos | No eventos adversos significativos |
| Lin et al.15, 2023 | 53/53 | Venus (28%), Pulsta (72%) | 27,5 meses | 98,1% | Sin insuficiencia protésica a los 12 meses | 1 embolización. 1 endocarditis |
NYHA: New York Heart Association; TSVD: tracto de salida del ventrículo derecho. En los estudios que no son específicos para TSVD nativo, los resultados y complicaciones hacen referencia a la cohorte global, ya que habitualmente no se detallan de forma independiente los resultados de TSVD nativo o no nativo. Hay centros que han participado en más de un estudio, lo que hace posible que el mismo paciente haya sido incluido en más de una publicación. Se han priorizado las series más recientes y con mayor número de pacientes. | ||||||
En un estudio en pacientes con TSVD nativo que incluyó 229 candidatos a Melody, finalmente se implantó la válvula en 132 (58%)11. El tamaño excesivo del TSVD fue el motivo más frecuente para no poder implantarla, seguido de la compresión coronaria o de la raíz aórtica. El resultado inmediato en los pacientes en quienes la válvula se implantó con éxito fue bueno, pero el bajo porcentaje de implantación demuestra la limitación que existe para el tratamiento de TSVD nativos con estas prótesis.
Las válvulas autoexpandibles vienen a llenar ese vacío al permitir tratar TSVD más grandes, adaptándose a la anatomía del TSVD y con una fijación más estable. Las series publicadas indican una tasa de éxito en el implante muy alta, cercana al 100%, con buenos resultados a corto y medio plazo, y escasas complicaciones12-16 (en la tabla 1 se resume una selección de series representativas de pacientes con TSVD nativo).
Resulta complicado establecer comparaciones entre los resultados de válvulas pulmonares quirúrgicas y percutáneas, ya que el tipo de pacientes y las anatomías tratadas son muy diferentes. En general, los pacientes a quienes se implantan válvulas percutáneas son de mayor riesgo y a menudo portadores de bioprótesis o con conductos pequeños que obligan a implantar válvulas percutáneas de menor tamaño, factor que se asocia a un mayor gradiente residual y esto, a su vez, a una mayor necesidad de reintervención4,8,9 y tasa más alta de endocarditis. Este aspecto ha penalizado tradicionalmente a las series con Melody (diámetro máximo de 22 mm), siendo la durabilidad uno de los problemas que se le han achacado, si bien las series más recientes muestran resultados positivos. En cuanto a la valvulación en TSVD nativo, solo se pueden establecer comparaciones indirectas.
PLANIFICACIÓN DEL PROCEDIMIENTO
Las técnicas de imagen multimodal, en especial la resonancia magnética y la tomografía computarizada, cobran especial relevancia para la selección de candidatos y la planificación del procedimiento; los aspectos clave son la medición del TSVD y del anillo pulmonar, y la valoración del tipo de anatomía del TSVD y de la anatomía coronaria. Recientemente se han publicado unas guías de tomografía computarizada para la evaluación del TSVD17, que explican detalladamente las medidas que se deben realizar, así como la fase del ciclo cardiaco.
POSIBLES PROBLEMAS
La migración o embolización de la prótesis o de los stents es una complicación posible en los pacientes con TSVD grandes donde no hay zona adecuada de anclaje, con una incidencia entre el 0 y el 4,5%11,10,18, por lo que es imprescindible elegir el tamaño adecuado de válvula.
Las fracturas del stent de la prótesis pueden producir pérdida de la integridad de esta y favorecer su disfunción, aunque la implicación del hallazgo casual de una fractura aislada de algún strut no está clara.
El daño de la válvula tricúspide se ha descrito en un 3 a 6%10 de los casos, pero se ha reducido mucho con el uso de vainas tipo DrySeal (W.L. Gore & Associates, Estados Unidos)10.
La compresión coronaria es una complicación rara en la actualidad, ya que sistemáticamente se realiza una coronariografía simultánea durante el test de inflado con balón en el TSVD, pero puede ser motivo de rechazo para el implante percutáneo en aproximadamente un 3% de los casos11.
Se ha comunicado una mayor incidencia de endocarditis infecciosa, en especial tras el implante de Melody6,8,9, con mayor riesgo cuando se implantan válvulas de menor tamaño y con mayor gradiente residual. El riesgo con otros tipos de válvulas, como la SAPIEN, ya sea por su diferente composición (yugular bovina la Melody, pericardio bovino la SAPIEN) o por tratarse de válvulas de mayor tamaño, es mucho más bajo9 y parece ser comparable al de las series quirúrgicas.
Las válvulas autoexpandibles son de mayor tamaño y con frecuen- cia el extremo proximal queda incluido dentro del TSVD, lo que podría aumentar el riesgo de arritmias ventriculares. Se han descrito incidencias muy variables de taquicardias ventriculares no sostenidas (entre el 0,6 y el 40%11,19,20), aunque en general se trata de un fenómeno transitorio en la fase precoz tras el implante y su implicación a largo plazo no está clara. Cabe destacar que, al comparar la sustitución valvular pulmonar quirúrgica y percutánea, la incidencia precoz de arritmias fue menor en el caso de la percutánea21. Un posible inconveniente es que el acceso con catéter al sustrato arrítmico puede quedar limitado tras el implante de la prótesis.
La presencia de la malla metálica de la prótesis con o sin stents previos en el interior del TSVD puede suponer una dificultad añadida para el cirujano en caso de precisar un recambio valvular quirúrgico ulterior. Esto es un problema relativo, ya que la sustitución valvular pulmonar quirúrgica también aumenta el riesgo en caso de reintervención futura en relación con la reesternotomía.
BENEFICIOS DE LA VALVULACIÓN PERCUTÁNEA
La posibilidad de realizar el implante de prótesis pulmonares por vía percutánea aporta ventajas evidentes: el procedimiento es mucho menos invasivo, la estancia hospitalaria es más corta8 y la recuperación es más rápida, todo ello con una mortalidad muy baja, entre el 0,2 y el 0,8%19, y con mejor coste-efectividad22. En los pacientes de alto riesgo quirúrgico puede representar la única opción de tratamiento. El recorrido realizado por sus «familiares» izquierdas, las válvulas transcatéter en posición aórtica, nos muestra que el umbral para las técnicas percutáneas va disminuyendo a medida que se gana experiencia y que la tecnología se refina. En casos de riesgo intermedio o bajo, el implante de una prótesis percutánea puede retrasar o evitar la necesidad de cirugía en pacientes que habitualmente requieren varias intervenciones a lo largo de su vida. Este concepto de ahorrar esternotomías es relevante por el riesgo añadido en las sucesivas cirugías y para aquellos pacientes candidatos a trasplante cardiaco. La decisión sobre el mejor modo de valvulación en cada paciente debe ser tomada por un equipo multidisciplinario (Heart Team) que incluya profesionales con experiencia en este tipo de cardiopatías.
CONCLUSIONES
Los pacientes con TSVD nativo representan un reto especial para el implante percutáneo de válvula pulmonar. A pesar de ello, es una opción factible y se está utilizando con una elevada tasa de éxito y escasas complicaciones, pero es esencial la adecuada selección de los candidatos. Varios modelos de válvulas autoexpandibles se han desarrollado específicamente para este fin, con buenos resultados a corto y medio plazo, y permiten el tratamiento de pacientes con TSVD grandes hasta ahora no abordables con prótesis con balón expandible. La información más reciente sugiere que la durabilidad de las prótesis percutáneas puede ser superponible a la de las bioprótesis quirúrgicas, aunque falta información a largo plazo, sobre todo con los modelos más nuevos. A pesar de que son necesarios más estudios y seguimiento, las técnicas percutáneas son ya una opción real para muchos pacientes y probablemente serán una alternativa al tratamiento quirúrgico en un futuro cercano.
FINANCIACIÓN
El presente trabajo no contó con financiación.
CONFLICTO DE INTERESES
No existen conflictos de intereses en relación con el presente artículo.
BIBLIOGRAFíA
1. Baumgartner H, De Baker J, Babu-Narayan S, et al. 2020 ESC Guidelines for the management of adult congenital heart disease. The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Eur Heart J. 2021;42:563-645.
2. Schievano S, Coats L, Migliavacca F, et al. Variations in Right Ventricular Outflow Tract Morphology Following Repair of Congenital Heart Disease:Implications for Percutaneous Pulmonary Valve Implantation. J Cardiovasc Magn Reson. 2007;9:687-695.
3. Gutiérrez-Larraya Aguado F, Pardeiro CA, Domingo EJB. Percutaneous treatment of pulmonary valve and arteries for the management of congenital heart disease. REC Interv Cardiol. 2021;3:119-128.
4. McElhinney DB, Zhang Y, Levi DS, et al. Reintervention and Survival After Transcatheter Pulmonary Valve Replacement. J Am Coll Cardiol. 2022;79:18-32.
5. Buber J, Egidy G, Huang A, et al. Durability of large diameter right ventricular out fl ow tract conduits in adults with congenital heart disease. Int J Cardiol. 2023;175:455-463.
6. Georgiev S, Ewert P, Eicken A, et al. Munich Comparative Study:Prospective Long-Term Outcome of the Transcatheter Melody Valve Versus Surgical Pulmonary Bioprosthesis with up to 12 Years of Follow-Up. Circ Cardiovasc Interv. 2020;13:1-7.
7. Ribeiro JM, Gonc L, Costa M. Transcatheter Versus Surgical Pulmonary Valve Replacement:A Systemic Review. Ann Thorac Surg. 2020;110:1751-1761.
8. Hribernik I, Thomson J, Ho A, et al. Comparative analysis of surgical and percutaneous pulmonary valve implants over a 20-year period. Eur J Cardiothoracic Surg. 2022;61:572-579.
9. Houeijeh A, Batteux C, Karsenty C, et al. Long-term outcomes of transcatheter pulmonary valve implantation with melody and SAPIEN valves. Int J Cardiol. 2023;370:156-166.
10. Shahanavaz S, Zahn EM, Levi DS, et al. Transcatheter Pulmonary Valve Replacement With the SAPIEN Prosthesis. J Am Coll Cardiol. 2020;76:2847-2858.
11. Martin MH, Meadows J, McElhinney DB, et al. Safety and Feasibility of Melody Transcatheter Pulmonary Valve Replacement in the Native Right Ventricular Outflow Tract:A Multicenter Pediatric Heart Network Scholar Study. JACC Cardiovasc Interv. 2018;11:1642-1650.
12. Lee S, Kim S, Kim Y. Mid-term outcomes of the Pulsta transcatheter pulmonary valve for the native right ventricular outflow tract. Catheter Cardiovasc Interv. 2021;98:E724-E732.
13. Garay F, Pan X, Zhang YJ, Wang C, Springmuller D. Early experience with the Venus p-valve for percutaneous pulmonary valve implantation in native outflow tract. Netherlands Hear J. 2017;25:76-81.
14. Álvarez-Fuente M, Toledano M, Hernández I, et al. Initial experience with the new percutaneous pulmonary self-expandable Venus P-valve. REC Interv Cardiol. 2023;5:263-269.
15. Lin MT, Chen CA, Chen SJ, et al. Self-Expanding Pulmonary Valves in 53 Patients With Native Repaired Right Ventricular Outflow Tracts. Can J Cardiol. 2023;39:997-1006.
16. Gillespie MJ, Bergersen L, Benson LN, Weng S, Cheatham JP. 5-Year Outcomes From the Harmony Native Outflow Tract Early Feasibility Study. JACC Cardiovasc Interv. 2021;14:816-817.
17. Han BK, Garcia S, Aboulhosn J, et al. Technical recommendations for computed tomography guidance of intervention in the right ventricular outflow tract:Native RVOT conduits and bioprosthetic valves:A white paper of the Society of Cardiovascular Computed Tomography (SCCT), Congenital Heart Surgeons'Society (CHSS), and Society for Cardiovascular Angiography &Interventions (SCAI). J Cardiovasc Comput Tomogr. 2023;18(2024):75-99.
18. Meadows JJ, Moore PM, Berman DP, et al. Congenital Heart Disease Use and Performance of the Melody Transcatheter Pulmonary Valve in Native and Postsurgical, Nonconduit Right Ventricular Outflow Tracts. Circ Cardiovasc Interv. 2014;7:374-380.
19. Goldstein BH, Bergersen L, Armstrong AK, et al. Adverse Events, Radiation Exposure, and Reinterventions Following Transcatheter Pulmonary Valve Replacement. J Am Coll Cardiol. 2020;75:363-376.
20. Taylor A, Yang J, Dubin A, et al. Ventricular arrhythmias following transcatheter pulmonary valve replacement with the harmony TPV25 device. Catheter Cardiovasc Interv. 2022;100:766-773.
21. Wadia SK, Lluri G, Aboulhosn JA, et al. Ventricular arrhythmia burden after transcatheter versus surgical pulmonary valve replacement. Heart. 2018;104:1791-1796.
22. Vergales JE, Wanchek T, Novicoff W, Kron IL, Lim DS. Cost-Analysis of Percutaneous Pulmonary Valve Implantation Compared to Surgical Pulmonary Valve Replacement. Catheter Cardiovasc Interv. 2013;82:1147-1153.
23. Malekzadeh-Milani S, Ladouceur M, Cohen S, Iserin L, Boudjemline Y. Results of transcatheter pulmonary valvulation in native or patched right ventricular outflow tracts. Arch Cardiovasc Dis. 2014;107:592-598.
24. Morgan GJ, Sadeghi S, Salem MM, et al. SAPIEN valve for percutaneous transcatheter pulmonary valve replacement without “pre-stenting“:A multi-institutional experience. Catheter Cardiovasc Interv. 2019;93:324-329.
25. Morgan G, Prachasilchai P, Promphan W, et al. Medium-term results of percutaneous pulmonary valve implantation using the Venus P-valve:international experience. EuroIntervention. 2019;14:1363-1370.
* Autor para correspondencia.
Correo electrónico: merascolunga@gmail.com (P. Merás Colunga).