INTRODUCCIÓN
Con frecuencia, al evaluar proyectos científicos o artículos se hacen objeciones que impiden su realización o publicación. En ocasiones, los fallos apuntados pueden no ser correctos o relevantes para el estudio. En este artículo repasaremos el tipo de objeciones más comunes que pueden frenar el avance de la investigación médica y apuntaremos formas de reducirlos.
OBJECIONES CLÍNICAS (O DE PROCEDIMIENTO) Y OBJECIONES ESTADÍSTICAS/METODOLÓGICAS
Las objeciones que el evaluador puede hacer a un proyecto de investigación se pueden agrupar en dos grandes categorías: clínicas (o de procedimiento) y estadísticas/metodológicas.
Las primeras las puede contestar, y en su caso rebatir, el autor del proyecto, porque se refieren al problema clínico que se está tratando y en ese tema el autor del proyecto tiene más capacidad, y a veces un conocimiento más actualizado, que el evaluador. Un ejemplo frecuente podría ser la objeción «el proyecto no especifica en qué condiciones se debe medir la presión arterial basal ni el criterio elegido para hablar de hipertensión»; el investigador puede reconocer el fallo que tiene su protocolo y subsanarlo, o bien pue- de argumentar que esa objeción es incorrecta.
La situación es distinta con las objeciones estadísticas/metodológicas. Los investigadores, independientemente de que actúen como evaluadores o como evaluados, habitualmente no son expertos en metodología de la investigación y bioestadística. A continuación, se presentan ejemplos de este tipo de objeciones.
Objeciones estadísticas/metodológicas erróneas frecuentes
Tamaño de la muestra
En contra de lo que creen la mayoría de los investigadores, la objeción sobre el insuficiente tamaño de la muestra es pertinente solo en situaciones muy especiales. En algunos casos no es acertada; por ejemplo, si se trata de un resultado con un valor p del test muy pequeño que constituye una fuerte evidencia contra la hipótesis nula. También carece de sentido en otras situaciones algo más complejas1.
Potencia estadística
La potencia depende de 4 parámetros, cuyo valor no suele estar previamente definido, de modo que dándoles unas cantidades adecuadamente elegidas por el investigador se puede obtener casi cualquier valor para la potencia del estudio. En realidad, cuando se pregunta por el valor de la potencia estadística no resulta suficiente con dar una cifra, pues es preciso conocer a qué valores de los otros parámetros corresponde esa potencia. Además, resulta evidente que modificando ligeramente esos valores dentro de rangos razonables se pueden obtener cantidades muy distintas para la potencia2.
Test sobre la distribución normal de la variable respuesta
En muchos casos esta objeción puede ser, incluso, doblemente equivocada: bien porque la variable respuesta es dicotómica y se tratará como tal en el análisis, o bien porque el tamaño de la muestra usado es superior a, digamos 30, y el teorema central del límite garantiza una muy buena aproximación a la distribución normal del estadístico utilizado en el test. Por supuesto, en ningún caso se puede garantizar que la variable tenga una distribución normal. Y en los casos en los que se puede demostrar que no la tiene, hay que tener en cuenta la robustez de algunos test paramétricos ante la no normalidad3. Y en los casos en que la asociación encontrada es muy fuerte y el valor de p del test es extremadamente pequeño, hay que tener en cuenta que si el verdadero valor de p del test fuera, por ejemplo, 10 veces mayor o 10 veces menor que el encontrado con el test paramétrico, la conclusión práctica sería la misma.
Grupo control y validez del estudio
Aunque un grupo control es una gran ayuda en muchas situaciones, exigir su presencia no debe convertirse en un mantra de aplicación universal e indiscutible. En algunas situaciones, los controles históricos, adecuadamente usados, aportan información suficiente para sacar conclusiones muy interesantes. En otros casos, cada paciente hace de control de sí mismo, permitiendo de este modo utilizar la variabilidad intraindividual, que suele ser menor que la variabilidad interindividual y, por ello, en muchos casos proporciona test más potentes.
Estudios piloto
Los ensayos clínicos aleatorizados (ECA) incorporan refinamientos metodológicos muy útiles para determinar con precisión la eficacia y la seguridad de un nuevo fármaco o procedimiento. Sin embargo, hay que tener en cuenta que los estudios piloto pueden incorporar esos mismos refinamientos metodológicos y ser controlados, aleatorizados y ciegos, de tal manera que el nivel de evidencia científica que aportan puede equipararse con el que aportan los ECA, reportando notables ventajas de ahorro de tiempo y dinero. Además, en general, su tamaño no es un factor determinante que les reste validez. ¿Cuál es entonces la diferencia fundamental entre ambos diseños? La diferencia no atañe al grado de evidencia que pueden aportar, sino al proceso administrativo implicado. Los ECA requieren la aprobación de comisiones externas hospitalarias, regionales o nacionales, mientras que los estudios piloto están avalados por la solvencia del equipo médico que los diseña. Para los evaluadores externos es más difícil hacer una valoración correcta de cada punto del proyecto y emitir un juicio certero, y si tienen la capacidad de vetar el estudio, existe la posibilidad de rechazarlo basándose en consideraciones insuficientemente fundadas.
Estudios observacionales
Los ECA ciegos se aceptan de manera generalizada como la mejor fuente de evidencia sobre la eficacia de los tratamientos y de los fármacos. Sin embargo, los estudios observacionales también pueden proporcionar información sobre la eficacia y la seguridad a largo plazo, que generalmente falta en los ECA. Además, son menos costosos, permiten estudiar eventos poco frecuentes y obtener información más rápido que los ECA. Los desarrollos, nuevos y en curso, en tecnología analítica y de datos ofrecen un futuro prometedor para los estudios observacionales, que ya desempeñan un papel importante en la investigación de los resultados de los tratamientos. Los datos de grandes estudios observacionales pueden aclarar el perfil de tolerabilidad de los fármacos y están particularmente indicados en grandes poblaciones heterogéneas de pacientes con enfermedades crónicas complejas. Los ECA y los estudios observacionales deben considerarse complementarios.
Estudios de casos y controles
De los estudios de casos y controles dice Rothman4 que «pasaron de ser la cenicienta de la investigación médica a ser una de sus estrellas más rutilantes». En el diseño de casos y controles es mucho más difícil evitar la distorsión producida por los factores de confusión, pero las técnicas de segmentación, emparejamiento y análisis multivariado palian parcialmente estos inconvenientes. En algunos casos, pueden aportar notable evidencia estadística con mucha menos inversión de tiempo y dinero que los ensayos clínicos. Veamos como ejemplo una enfermedad que afecta al 1% de las personas que no siguen una determinada dieta y al 5% de las personas que la siguen, y sabemos que esa dieta la sigue el 40% de la población. Si nos planteamos un estudio prospectivo tomaremos 80 personas en el grupo que sigue la dieta y otras 80 en el grupo control, y tras el tiempo acordado mediremos la incidencia de la enfermedad en cada uno de los dos grupos. La potencia estadística de este estudio para un valor alfa de 0,05 sería del 8%. Si nos planteamos un estudio de casos y controles tomaremos 80 pacientes con la enfermedad y 80 sin ella, y con una historia clínica muy detallada averiguaremos la proporción de personas que siguen esa dieta en cada uno de los dos grupos. La potencia estadística sería del 93%.
La lista de objeciones erróneas es mucho más larga y cada una de ellas requeriría un artículo dedicado a explicarla.
CONCLUSIONES
Algunas de las objeciones metodológicas que hacen los evaluadores están equivocadas. En la mayoría de estos casos, el evaluado asume que su proyecto tiene algún fallo importante y acaba abandonándolo. De este modo, bastantes proyectos que podrían haber aportado información útil son injustamente desechados, lo cual ralentiza el avance de la medicina.
Consideramos que esa anomalía se evitaría en gran parte si: a) los evaluadores plantearan objeciones metodológicas solo en aquellos aspectos que conocen suficientemente; b) siempre que fuera posible, el juicio emitido por los evaluadores de las agencias de salud y de los comités de bioética tuviera carácter de sugerencia, sin posibilidad de veto; c) se reconociera el papel fundamental de los estudios observacionales, que pueden ser muy eficaces y, por lo general, con un coste mucho menor que los ensayos clínicos; d) se hicieran, en los muchos casos en que están indicados, estudios piloto, que pueden ser controlados, aleatorizados y ciegos, pero sin las restricciones de los ECA (figura 1).
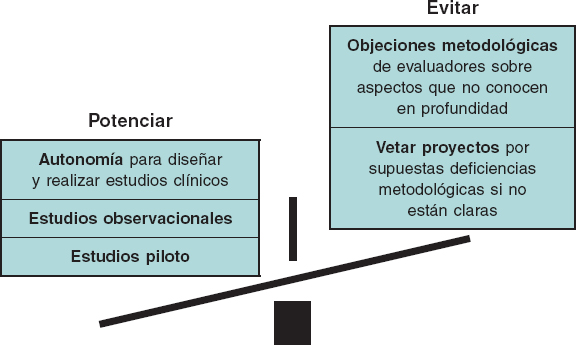
Figura 1. Medidas para agilizar la investigación médica favoreciendo la autonomía de los médicos cualificados, evitando objeciones metodológicas no justificadas y potenciando el uso de diseños a los que en la actualidad no se presta la atención que merecen.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Los autores declaran no tener conflictos de intereses respecto al presente artículo.
BIBLIOGRAFÍA
1. Egbuchulem KI. The basics of sample size estimation:an editor's view. Ann Ib Postgrad Med. 2023;21:5-10.
2. Prieto-Valiente L, Carazo-Díaz C. Potencia estadística en investigación médica. ¿Quépostura tomar cuando los resultados de la investigación son significativos?Rev Neurol. 2023;77:171-173.
3. Roco-Videla A, Landabur Ayala R, Maureira Carsalade N, Olguín-Barraza M. ¿Cómo determinar efectivamente si una serie de datos sigue una distribución normal cuando el tamaño muestral es pequeño?Nutr Hosp. 2023;40:234-235.
4. Rothman KJ. The origin of Modern Epidemiology, the book. Eur J Epidemiol. 2021;36:763-765.
* Autor para correspondencia.
Correo electrónico: mmselles@secardiologia.es (M. Martínez-Sellés).