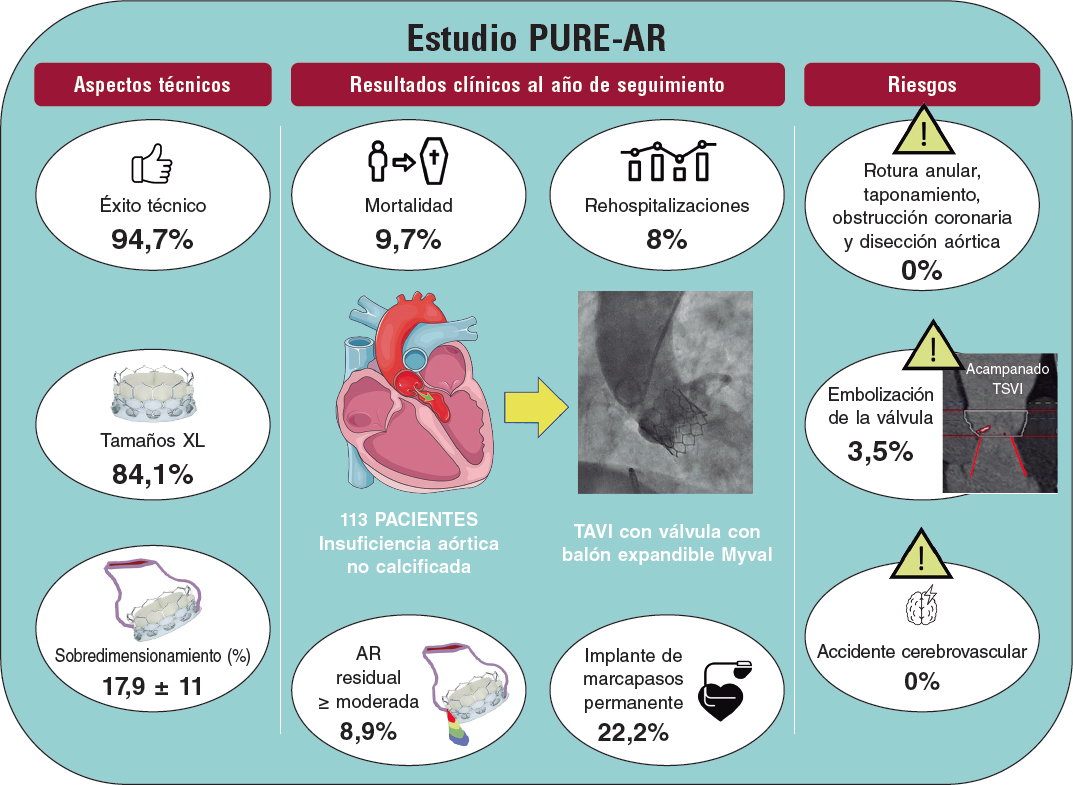
RESUMEN
Introducción y objetivos: Pese a que los stents farmacoactivos son el tratamiento principal en las angioplastias coronarias, los balones farmacoactivos representan una alternativa interesante dado que eliminan el riesgo de trombosis del stent sin dejar ningún tipo de estructura metálica en la pared del vaso. No obstante, la evidencia en cuanto a los procesos de cicatrización de la pared del vaso, el remodelado, los cambios en la composición de la placa ateroesclerótica y el impacto en la microcirculación coronaria tras el intervencionismo coronario percutáneo (ICP) con balón farmacoactivo aún no se ha esclarecido.
Métodos: Estudio piloto abierto, de un solo grupo, iniciado por el investigador, de 30 pacientes con enfermedad de vaso nativo sometidos a ICP con balón farmacoactivo. Se realizará ecografía intravascular y se determinará el índice de resistencia microvascular derivado de la angiografía (angio-IRM) antes, inmediatamente después y a los 3 meses de seguimiento de la angioplastia.
Conclusiones: Se aportará nueva evidencia sobre la modificación de la placa en pacientes con enfermedad de vaso nativo tratados con balón farmacoactivo, evaluando el cambio en el porcentaje del volumen de ateroma y el aumento luminal tardío, así como los cambios en la microcirculación mediante angio-IRM.
Registrado en Clinicaltrials.gov (NCT06080919).
Palabras clave: Balón farmacoactivo. Ecografía intravascular. Índice de resistencia microvascular derivado de la angiografía.
ABSTRACT
Introduction and objectives: Although drug-eluting stents are the main treatment in percutaneous coronary interventions (PCI), drug-coated balloons (DCB) represent an appealing alternative as they eliminate the risk of stent thrombosis and avoid leaving any metal structure in the vessel wall. However, limited evidence has been published to date on the vessel wall healing processes, plaque remodeling, plaque composition, and the impact on the coronary microcirculation after percutaneous coronary intervention with DCB (DCB-PCI).
Methods: This is investigator-initiated, single-center, single-arm, open-label, pilot study of 30 patients with native vessel disease undergoing DCB-PCI. Intravascular ultrasound and angiography-derived index of microvascular resistance (IMRangio) will be performed before and immediately after PCI, and at 3 months of follow-up.
Conclusions: The study aims to provide new evidence on the modification of atherosclerotic plaque in patients with de novo lesions undergoing PCI with DCB. This will be assessed by examining the change in the percentage of atheroma volume and late lumen enlargement using intravascular ultrasound and by evaluating changes in the microcirculation using IMRangio.
Registered at Clinicaltrials.gov (NCT06080919).
Keywords: Drug-coated balloon. Intravascular ultrasound. Angiography-derived index of microvascular resistance.
Abreviaturas Angio-IRM: índice de resistencia microcirculatoria obtenido mediante coronariografía. BFA: balón farmacoactivo. ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. MEE: membrana elástica externa.
INTRODUCCIÓN
La enfermedad coronaria es la principal causa de mortalidad en todo el mundo, responsable de más de 7 millones de muertes al año1 y su prevalencia ha aumentado en los últimos 20 años2. La intervención coronaria percutánea (ICP) ha sido fundamental en el tratamiento de la enfermedad coronaria3,4. La llegada de los stents farmacoactivos (SFA) ha reducido sustancialmente las tasas de reestenosis gracias a la liberación de fármacos antiproliferativos en la pared vascular. Con el paso de los años, los SFA se han convertido en el patrón oro durante la realización de ICP5. Los balones farmacoactivos (BFA) son una alternativa en el contexto de las ICP. Los BFA incorporan un balón recubierto de agentes antiproliferativos encapsulados en una matriz polimérica6. Al inflarse, el balón libera el fármaco antiproliferativo al contacto en la pared vascular. El principal objetivo de los BFA es eliminar el riesgo de trombosis del stent y reducir las tasas de reestenosis ya que no dejan ningún tipo de estructura metálica en el segmento tratado6.
El perfil de seguridad y eficacia de los BFA se ha estudiado ampliamente en el tratamiento de la enfermedad coronaria de novo6. En la enfermedad de pequeños vasos, los BFA han demostrado no ser inferiores a los SFA en varios ensayos clínicos aleatorizados7. Un reciente metanálisis ha demostrado que, comparados con los SFA, los BFA se asocian a un menor riesgo de trombosis del vaso y a un menor riesgo de infarto agudo de miocardio8. En lesiones de novo en vasos grandes, los datos actuales no avalan el uso generalizado de BFA en detrimento de SFA, si bien los primeros parecen ser seguros y eficaces9,10. En cualquier caso, es necesario determinar la cuestión de la liberación del fármaco en la pared vascular, los procesos de cicatrización, el remodelado y composición de la placa, así como el impacto sobre la microcirculación coronaria tras una ICP con BFA.
El presente trabajo describe el diseño y justificación de un estudio de modificación de la placa y el impacto en la microcirculación tras una ICP con BFA (el estudio PLAMI).
MÉTODOS
El estudio será un estudio piloto, abierto, de un único brazo, iniciado por el investigador y unicéntrico de pacientes tratados con ICP y BFA para el manejo de lesiones de novo. El estudio ha sido aprobado por el comité de ética hospitalaria en investigación de productos médicos y está registrado en ClinicalTrials.gov (NCT06080919).
Intervención
Se informará a los pacientes elegibles sobre el estudio y se les pedirá que den su consentimiento informado por escrito antes de ser incluidos en el estudio. Se tratará a los pacientes con una ICP-BFA guiada bajo ecografía intravascular (IVUS). Se hará una valoración de la fisiología coronaria derivada de angiografía tras la intervención con el software Angio Plus (Pulse Medical Imaging Technology, China). Las imágenes angiográficas se emplearán para conocer los valores del índice de resistencia microcirculatoria obtenido mediante coronariografía (angio-IRM), antes y después de la ICP-BFA. Todas las intervenciones se llevarán a cabo en conformidad con las guías europeas vigentes5: se predilatará la lesión diana con balones semidistensibles o no distensibles, con un diámetro igual al del diámetro del vaso de referencia y con la longitud adecuada. Se aceptarán varias predilataciones. El BFA será el balón recubierto de paclitaxel Pantera Lux (BIOTRONIK AG, Suiza).
Luego, la lesión se tratará con un BFA con una relación diámetro del vaso de referencia/diámetro del balón de 1:1. La longitud del BFA será igual a la longitud de la lesión + 5 mm. El tiempo de inflado del BFA será de entre 45 y 60 segundos para garantizar la correcta y completa liberación del fármaco. Las razones preespecificadas para la implantación del SFA tras la ICP-BFA serán una estenosis residual > 30%, disecciones > tipo B y un grado de flujo TIMI < 36. Tanto seguimiento angiográfico con IVUS como la valoración del angio-IRM se realizarán 3 meses después de la primera intervención. El cronograma del estudio se resume en la figura 1.
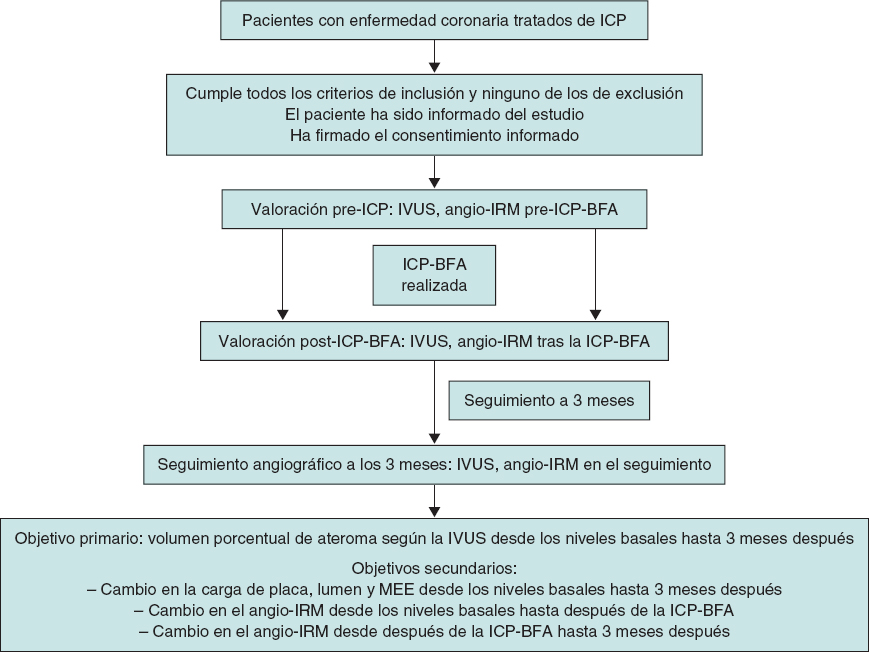
Figura 1. Cronograma del estudio PLAMI. BFA: balón farmacoactivo; angio-IRM: índice de resistencia microcirculatoria obtenido mediante coronariografía; ICP: intervención coronaria percutánea: IVUS: ecografía intravascular.
Se tomarán imágenes IVUS antes de realizar la ICP-BFA, inmediatamente después y a los 3 meses de seguimiento utilizando el sistema Opticross HD de 60 MHz (Boston Scientific Corp, Estados Unidos). Todas las IVUS se realizarán tras la administración intracoronaria de 200 μg de nitroglicerina. Las imágenes IVUS se obtendrán a 30 frames por segundo con pullback automático del transductor a 0,5 mm/segundo hasta la lesión del vaso de referencia proximal. Como no habrá stents a modo de referencia, las ramas laterales proximales y distales adyacentes a la lesión tratada servirán de referencia, coincidiendo con las imágenes de la coronariografía (figura 2). Todas las imágenes IVUS serán analizadas por un laboratorio central independiente.
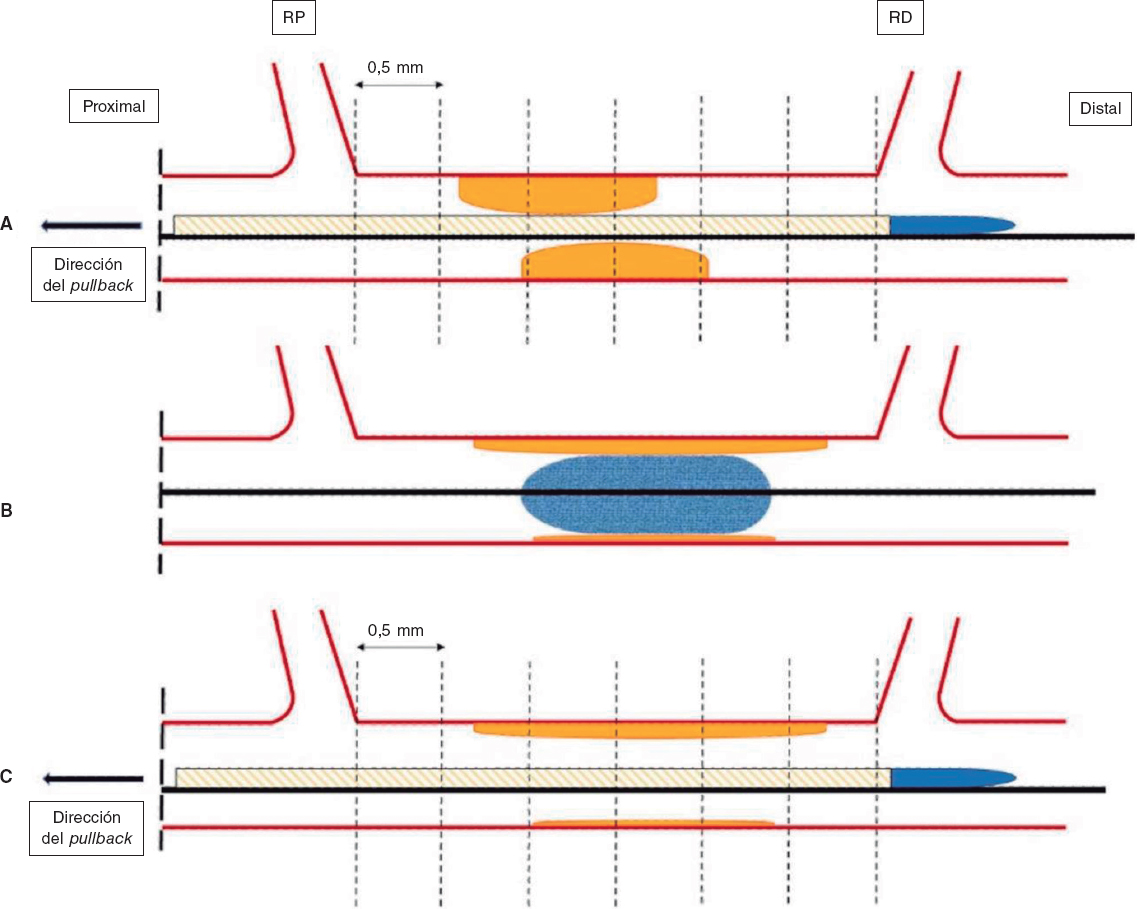
Figura 2. Representación esquemática de la adquisición de IVUS. Las imágenes IVUS se obtendrán antes (A) y después (C) de la ICP-BFA (B) a 30 frames por segundo con pullback automático del transductor a 0,5 mm/segundo hasta la lesión proximal del vaso referencia. Se analizará el mismo corte anatómico antes, después y a los 3 meses de seguimiento tras la ICP utilizando puntos de referencia reproducibles (ramas laterales). El primer frame analizado será el punto dis- tal del vaso tratado previo a la salida de la RD (representada por la línea punteada más a la derecha), y el último frame, el punto proximal del vaso antes de la división de la RP. ICP-BFA: intervención coronaria percutánea con balón farmacoactivo; IVUS: ecografía intravascular; RD: rama distal; RP: rama proximal.
La evaluación de la fisiología coronaria derivada de la angiografía se realizará con el software Angio Plus (Pulse Medical Imaging Technology, China). Para valorar cada lesión, se seleccionarán 2 proyecciones como mínimo, con una diferencia de > 25°. El operador marcará manualmente los puntos proximales y distales a la lesión y el sistema perfilará los contornos del vaso detectado de forma automática. Si la trayectoria del vaso trazado se desvía de la luz normal, se harán los cambios manuales necesarios. El software asistido por inteligencia artificial combina la información procedente de las imágenes intravasculares con el flujo del vaso estimado para obtener el angio-IRM. Todas las imágenes angiográficas se analizarán en un laboratorio central independiente para obtener el angio-IRM.
Población del estudio y criterios de inclusión
Se cribará a los pacientes para asegurarse de que cumplen los criterios de inclusión y ninguno de los de exclusión antes de inscribirse en el estudio. Los criterios de inclusión consisten en una indicación para tratar una lesión de novo con una ICP según las guías actuales (sin restricciones en lo que se refiere al tamaño del vaso)5. Los criterios de inclusión y exclusión se resumen en la tabla 1.
Tabla 1. Criterios de inclusión y exclusión
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| Paciente con EC tratados con ICP-BFA sin limitación del tamaño de vaso | Edad < 18 años |
| Shock cardiogénico | |
| Infarto agudo de miocardio con elevación del segmento ST | |
| Uso de soporte circulatorio mecánico | |
| Lesiones coronarias complejas* incluidas oclusiones totales crónicas, lesiones en bifurcación, enfermedad del tronco común izquierdo, lesiones calcificadas graves, intervenciones en injertos y reestenosis intrastent | |
| Incapacidad para dar el consentimiento informado | |
| Incapacidad para entender y seguir las instrucciones relacionadas con el estudio o bien para cumplir con el protocolo del mismo | |
| Participación actual en otro ensayo clínico | |
| Mujeres embarazadas | |
BFA: balón farmacoactivo; EC: enfermedad coronaria; ICP: intervención coronaria percutánea. * Lesiones coronarias complejas según la definición de Lawton et al.11. | |
Tamaño de la muestra
Debido a la naturaleza exploratoria de este estudio, no se requiere un cálculo formal del tamaño de la muestra. Basándonos en estudios piloto previos con diseños similares12, se espera una muestra de 30 lesiones para poder valorar el impacto de los BFA tanto en la curación coronaria como en el territorio microcirculatorio.
Objetivos del estudio
El objetivo primario es el cambio en el volumen porcentual de ateroma calculado mediante IVUS desde niveles basales hasta 3 meses después. Los objetivos secundarios incluirán a) cambios en el área luminal desde niveles basales hasta 3 meses después (áreas mínimas, máximas y promedio), b) el porcentaje de progresores y regresores, c) cambios en el área de la membrana elástica externa (MEE) desde niveles basales hasta después de la ICP-BFA (promedio), d) cambios en el área de la MEE tras la ICP-BFA hasta 3 meses después (promedio), e) el porcentaje de tipos de remodelado (neutral, negativo y positivo), f) cambios en el angio-IRM desde niveles basales hasta después de la ICP-BFA, g) cambios en el angio-IRM desde después de la ICP-BFA hasta 3 meses después.
Un comité independiente de eventos clínicos, compuesto por cardiólogos que no participan en el ensayo, revisará y adjudicará todos los eventos cardiovasculares adversos mayores según el protocolo del estudio.
Considerando el área luminal como el área delimitada por el borde luminal, el área luminal mínima se define como el área luminal más pequeña dentro de la longitud de la lesión tratada13,14. La carga de ateroma o placa se define como la relación entre el área de ateroma y la MEE del vaso y se calcula dividiendo el área de placa más el área transversal (AT) media por el AT de la MEE13,14. Como el área de ateroma se puede calcular en cada frame, el volumen total de ateroma se obtiene sumando las diferencias entre el AT de la MEE y el AT luminal de todas las imágenes disponibles15. El porcentaje del volumen de la MEE ocupado por el ateroma se denomina volumen porcentual de ateroma15,16.
Los tipos de remodelado arterial en serie se clasificarán como de costumbre: neutros si no hay cambio en la MEE, negativos si se observa una disminución de la MEE y positivos si sucede al revés.
Consideraciones estadísticas
Las variables continuas se expresarán como media ± desviación estándar o mediana [rango intercuartílico], y las categóricas, como porcentajes. Se utilizará la prueba t emparejada para comparar las variables continuas antes y después del tratamiento en el mismo paciente; las diferencias en las proporciones quedarán registradas con la prueba de la X2 o la prueba exacta de Fisher. Los valores de p < 0,05 (típicamente ≤ 0,05) se considerará estadísticamente significativo. Los análisis estadísticos se realizarán con el software Stata versión 13.1 (StataCorp LP, Estados Unidos).
DISCUSIÓN
Aunque el uso de SFA sigue siendo predominante durante la realización de ICP, complicaciones tales como la trombosis del stent y la reestenosis intrastent han llevado a desarrollar BFA. Estos últimos ofrecen, teóricamente, el beneficio de no dejar material metálico en la luz vascular, reduciendo, así, la posibilidad de complicaciones mecánicas tales como la malaposición, fractura y trombosis del stent. Esto podría reducir la proliferación neointimal y acortar la duración del tratamiento antiagregante plaquetario doble6. Las actuales guías atribuyen una recomendación de nivel IA al tratamiento de la reestenosis intrastent5. Aunque el uso de BFA en lesiones de novo parece prometedor, aún no está muy extendido. Además, la ICP no está exenta de riesgos, ya que acarrea un cierto grado de lesión en la pared arterial secundario a los inflados del balón y a los struts del stent17,19. La respuesta vascular a la lesión que dan tanto las células endoteliales como las musculares lisas supone una compleja red de respuestas bioquímicas con compromiso del sistema inmunológico. Todos estos factores regulan los procesos de hiperplasia neointimal, remodelado vascular y reendotelialización normal de la pared arterial17.
La fisiopatología de la reestenosis y la pérdida de luz tras una angioplastia es un proceso complejo que implica varios factores y que no se limita, solo, a la hiperplasia neointimal19. Agudamente, la intervención coronaria percutánea con balón (ICP-balón) genera una mayor área luminal principalmente por la expansión de la MEE, algo que se atribuye, principalmente, a las propiedades elásticas del vaso más que a la compresión o eliminación de la placa aterosclerótica20. Después, durante los primeros minutos tras la ICP, se produce un «recoil agudo» debido a las propiedades elásticas de la pared arterial. En la fase crónica, los datos de la IVUS indican que la pérdida luminal se debe principalmente al descenso progresivo de la MEE más que a un aumento del volumen de la placa aterosclerótica. A diferencia de la fase aguda, donde la pérdida de área se debe únicamente a las propiedades elásticas, el «recoil crónico» que provoca la pérdida de área también implica una serie de factores tales como fibrosis, apoptosis y cambios en la matriz extracelular19,21. Curiosamente, no todos los pacientes muestran un remodelado negativo con un descenso de la MEE; en torno al 25% muestra un aumento persistente de la MEE asociado a una tasa más baja de reestenosis. En este sentido, la reestenosis parece deberse principalmente a la dirección y magnitud de los cambios en el remodelado arterial19, aunque la hiperplasia neointimal también influye.
No obstante, la evidencia científica de que disponemos se basa en el análisis tras el uso de balones tradicionales. Con la ICP-BFA se ha observado un agrandamiento tardío de la luz comparado con la ICP-balón20. Aunque este hallazgo se ha atribuido en parte a la inhibición de la proliferación neointimal por los fármacos antiproliferativos22, el papel que tiene la modificación de la placa o los fenómenos de cicatrización vascular en este proceso tampoco se puede descartar. Un estudio previo confirmó que el agrandamiento tardío de la luz fue mayor en áreas con una mayor carga de placa; no obstante, ese estudio fue una evaluación retrospectiva que empleó un protocolo de angiografía coronaria cuantitativa23. Se podría plantear que, induciendo un daño controlado a la pared arterial sumado al efecto antiproliferativo del BFA, se lograría, en principio, un remodelado vascular positivo que redujese las tasas de reestenosis evitando tener que implantar un SFA. En este sentido, con la ICP-BFA no solo se puede tratar la estenosis coronaria desde un punto de vista mecánico, sino también cambiar la historia natural tanto de la enfermedad como de la reestenosis. En este sentido, el análisis de la IVUS es clave para poder analizar los porqués de la ganancia o pérdida del área luminal. Los cambios dinámicos que se producen tras la ICP se muestran en la figura 3.
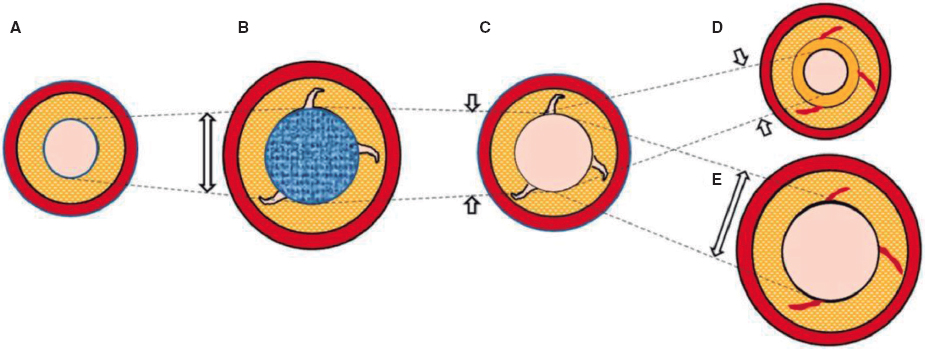
Figura 3. Figura central. Representación esquemática del cronograma de la ICP-BFA y la variación de la luz. A: lesión de novo pre-ICP-BFA. B: ICP-BFA (azul) lesionando la pared vascular y aumentando la luz y el AT de la MEE. C: recoil agudo. D: recoil crónico con disminución de la MEE e hiperplasia neointimal. E: ETL debido al mantenimiento del área de la MEE y ausencia de hiperplasia neointimal. Las líneas punteadas representan las variaciones del área luminal a lo largo de todo el proceso. La imagen ejemplifica cómo los cambios en el área luminal y la carga de placa se deben, principalmente, a variaciones en la MEE y no a la compresión de la placa. AT: área transversal; ICP-BFA: intervención coronaria percutánea con balón farmacoactivo; ETL: ensanchamiento tardío del lumen; MEE: membrana elástica externa.
El BFA que se usará en nuestro estudio, de paclitaxel, ha sido ampliamente analizado como un balón farmacoactivo por sus propiedades lipofílicas y capacidad de liberarse en la pared vascular24. Además, los BFA de paclitaxel disponibles han mostrado buenos resultados en pacientes tratados de ICP con enfermedad de los vasos nativos25. En cambio, debido a las características hidrofóbicas del sirolimus, mantener un porcentaje adecuado en la pared a medio plazo plantea desafíos técnicos. No obstante, se espera que los avances en la formulación de la nueva generación de BFA liberadores de sirolimus resuelvan este problema y faciliten una liberación adecuada del fármaco en la pared vascular24.
Como se ha mencionado anteriormente, la microcirculación coronaria está estrechamente ligada al funcionamiento adecuado de las coronarias y a la fisiopatología de la enfermedad coronaria. Aunque se cree que el rendimiento de la ICP, la lesión y curación de las coronarias influyen en la microcirculación coronaria, hay pocas evidencias en torno a la ICP-BFA. Además, la rotura de la placa, las disecciones intimales y la formación de trombos que sobrevienen durante la angioplastia con balón son una fuente potencial de embolismos en el lecho microvascular.
Como la visualización directa de la microcirculación no es viable en la práctica clínica26, su estudio se basa en parámetros que reflejan su estado funcional, normalmente la reserva de flujo coronario y el IRM. La primera se define como la relación entre el flujo hiperémico en respuesta a la vasodilatación no endotelial y al flujo sanguíneo en reposo. Es esencial descartar la estenosis epicárdica antes de emplear la reserva de flujo coronario ya que proporciona una medición integrada tanto de la microcirculación epicárdica como coronaria26. El IRM se calcula como el producto de la presión coronaria distal en hiperemia máxima multiplicado por el tiempo de tránsito medio hiperémico.
En nuestro estudio, realizaremos una valoración no invasiva y no hiperémica de la microcirculación coronaria utilizando angio-IRM. Este abordaje pretende caracterizar el estado basal de la microcirculación y evaluar los cambios en la microcirculación inducidos por la ICP y su variación durante un período de 3 meses.
Al hacer seguimiento del angio-IRM antes y después de tratar la lesión epicárdica estenótica, podremos valorar los efectos de la fractura aguda de la placa aterosclerótica y la lesión en la pared arterial del lecho microvascular. También pretendemos investigar si estos perjudiciales cambios colaterales provocados durante la angioplastia se mantienen de manera consistente o varían significativamente tras 3 meses de seguimiento. En este mismo contexto, el análisis de la IVUS durante el seguimiento nos permitirá correlacionar los cambios en la pared arterial y la placa aterosclerótica tras la ICP-BFA con la fisiología de la microcirculación. Hasta la fecha, no hay más información en la literatura publicada sobre el proceso anatómico y fisiológico que sobreviene durante la curación de la pared arterial lesionada tras la ICP-BFA.
CONCLUSIONES
El PLAMI es un primer estudio piloto realizado en humanos cuyo objetivo es proporcionar información nueva sobre la modificación de la placa aterosclerótica evaluada mediante imágenes intracoronarias en pacientes con lesiones de novo tratados con ICP-BFA.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
Este estudio ha sido aprobado por el comité de ética hospitalario para la investigación sobre productos médicos. Los pacientes elegibles serán informados sobre el estudio y deberán dar su consentimiento informado por escrito antes de ser incluidos en el mismo. Se han tenido en cuenta los posibles sesgos de género y sexo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha utilizado inteligencia artificial en la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORES
J.A. Sorolla Romero, A. Teira Calderón, J. Sanz Sánchez y H.M. García-García contribuyeron a la idea, diseño, redacción y revisión del artículo. J.P. Vílchez Tschischke, P. Aguar Carrascosa, F. Ten Morro, L. Andrés Lalaguna, L. Martínez Dolz y J.L. Díez Gil contribuyeron a la revisión crítica de su contenido intelectual.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- Los BFA han demostrado su eficacia clínica en casos de reestenosis intrastent y lesiones de novo de enfermedad de pequeño vaso.
- Varios estudios sobre la enfermedad coronaria de pequeño vaso han demostrado que los BFA resultan beneficiosos en la pared vascular, con un ensanchamiento tardío de la luz durante el seguimiento.
- No obstante, existe poca evidencia sobre su uso en vasos más grandes.
- Además, hasta la fecha, no se ha evaluado el impacto de los BFA en la microcirculación coronaria.
¿QUÉ APORTA DE NUEVO?
- El objetivo del estudio PLAMI es caracterizar la cicatrización de los vasos utilizando IVUS tras la ICP-BFA en pacientes con enfermedad de los vasos nativos y correlacionar estos hallazgos con el impacto en la microcirculación.
BIBLIOGRAFÍA
1. Ralapanawa U, Sivakanesan R. Epidemiology and the Magnitude of Coronary Artery Disease and Acute Coronary Syndrome:A Narrative Review. J Epidemiol Glob Health. 2021;11:169-177.
2. Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140:e596-e646.
3. Canfield J, Totary-Jain H. 40 Years of Percutaneous Coronary Intervention:History and Future Directions. J Pers Med. 2018;8:33.
4. Stefanini GG, Alfonso F, Barbato E, et al. Management of myocardial revascularisation failure:an expert consensus document of the EAPCI. EuroIntervention. 2020;16:e875-e890.
5. Neumann F, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
6. Jeger RV, Eccleshall S, Wan Ahmad WA, et al. Drug-Coated Balloons for Coronary Artery Disease:Third Report of the International DCB Consensus Group. JACC Cardiovasc Interv. 2020;13:1391-1402.
7. Tang Y, Qiao S, Su X, et al. Drug-Coated Balloon Versus Drug-Eluting Stent for Small-Vessel Disease:The RESTORE SVD China Randomized Trial. JACC Cardiovasc Interv. 2018;11:2381-2392.
8. Sanz Sánchez J, Chiarito M, Cortese B, et al. Drug-Coated balloons vs drug-eluting stents for the treatment of small coronary artery disease:A meta-analysis of randomized trials. Catheter Cardiovasc Interv. 2021;98:66-75.
9. Yerasi C, Case BC, Forrestal BJ, et al. Drug-Coated Balloon for de Novo Coronary Artery Disease:JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75:1061-1073.
10. Nishiyama N, Komatsu T, Kuroyanagi T, et al. Clinical value of drug-coated balloon angioplasty for de novo lesions in patients with coronary artery disease. Int J Cardiol. 2016;222:113-118.
11. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization. J Am Coll Cardiol. 2022;79:e21-e129.
12. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol. 2006;48:193-202.
13. Xu J, Lo S. Fundamentals and role of intravascular ultrasound in percutaneous coronary intervention. Cardiovasc Diagn Ther. 2020;10:1358-1370.
14. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37:1478-1492.
15. Gogas BD, Farooq V, Serruys PW, Garcia-Garcia HM. Assessment of coronary atherosclerosis by IVUS and IVUS-based imaging modalities:progression and regression studies, tissue composition and beyond. Int J Cardiovasc Imaging. 2011;27:225-237.
16. Tobis JM, Perlowski A. Atheroma Volume by Intravascular Ultrasound as a Surrogate for Clinical End Points. J Am Coll Cardiol. 2009;53:1116-1118.
17. Feinberg MW. Healing the injured vessel wall using microRNA-facilitated gene delivery. J Clin Invest. 2014;124:3694-3697.
18. Inoue T, Croce K, Morooka T, Sakuma M, Node K, Simon DI. Vascular Inflammation and Repair:Implications for Reendothelialization, Restenosis, and Stent Thrombosis. JACC Cardiovasc Interv. 2011;4:1057-1066.
19. Mintz GS, Popma JJ, Pichard AD, et al. Arterial Remodeling After Coronary Angioplasty. Circulation. 1996;94:35-43.
20. Her AY, Ann SH, Singh GB, et al. Comparison of Paclitaxel-Coated Balloon Treatment and Plain Old Balloon Angioplasty for De Novo Coronary Lesions. Yonsei Med J. 2016;57:337-341.
21. Geary RL, Nikkari ST, Wagner WD, Williams JK, Adams MR, Dean RH. Wound healing:A paradigm for lumen narrowing after arterial reconstruction. J Vasc Surg. 1998;27:96-108.
22. Sogabe K, Koide M, Fukui K, et al. Optical coherence tomography analysis of late lumen enlargement after paclitaxel-coated balloon angioplasty for de-novo coronary artery disease. Catheter Cardiovasc Interv. 2021;98:E35-E42.
23. Kleber FX, Schulz A, Waliszewski M, et al. Local paclitaxel induces late lumen enlargement in coronary arteries after balloon angioplasty. Clin Res Cardiol. 2015;104:217-225.
24. Yerasi C, Case BC, Forrestal BJ, et al. Drug-Coated Balloon for De Novo Coronary Artery Disease:JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;75:1061-1073.
25. Venetsanos D, Omerovic E, Sarno G, et al. Long term outcome after treatment of de novo coronary artery lesions using three different drug coated balloons. Int J Cardiol. 2021;325:30-36.
26. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology &Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. Eur Heart J. 2020;41:3504-3520.
* Autores para correspondencia.
Correos electrónicos: sjorge4@gmx.com (J. Sanz Sánchez); hector.m.garciagarcia@medstar.net; hect2701@gmail.com (H.M. Garcia-Garcia).