RESUMEN
La enfermedad del tronco coronario izquierdo ha permanecido muchos años como la última frontera que se resistía al intervencionismo coronario percutáneo. Hasta hace poco tiempo, los estudios clínicos más relevantes en este campo, así como las guías clínicas, han sido favorables a la revascularización quirúrgica casi como forma exclusiva de tratamiento de esta patología. Los cambios ocurridos en los últimos 10-15 años, desde la aparición de los stents farmacoactivos y su mejora tecnológica, han sido vertiginosos. La realización de estudios aleatorizados que han comparado ambas modalidades de revascularización ha llevado al intervencionismo percutáneo a la altura de la cirugía en un alto porcentaje de pacientes. Los aspectos anatómicos, técnicos y de estrategia son fundamentales en el tratamiento percutáneo de estas lesiones, dada su enorme variabilidad clínica. En tanto los estudios clínicos futuros no se decanten definitivamente a favor de la revascularización percutánea o de la quirúrgica, la discusión individualizada de cada caso en un equipo multidisciplinario y las preferencias de los pacientes deberían guiar la decisión clínica.
Palabras clave: Enfermedad coronaria. Tronco coronario izquierdo. Intervencionismo coronario percutáneo. Cirugía de revascularización coronaria.
Abstract
For many years, the left main coronary artery disease has remained as the last frontier resisting percutaneous coronary intervention. Until recently, the most relevant clinical studies on this regard as well as clinical practice guidelines favored surgical revascularization almost as the only treatment pathway for the management of this condition. The changes that have occurred over the last 10 to 15 years since the appearance of drug-eluting stents and their technological advances have been extraordinary. This added to the publication of randomized clinical trials that compared both revascularization modalities has placed percutaneous coronary interventions at a similar level to surgery in a large number of patients. The anatomical, technical, and strategic aspects are essential for the percutaneous management of left main coronary artery lesions given their tremendous clinical variability. In this article we will be reviewing their anatomy, angiography, intracoronary diagnostic techniques, and different percutaneous revascularization strategies. As long as future clinical studies do not definitively favor percutaneous over surgical revascularization or vice versa, individual discussions on each particular case by the heart team and our patients’ preferences should guide our clinical decision-making process.
Keywords: Coronary artery disease. Left main coronary artery. Percutaneous coronary intervention. Coronary artery bypass graft.
Abreviaturas CABG: cirugía de revascularización coronaria. Cx: arteria coronaria circunfleja. DA: arteria coronaria descendente anterior. ICP: intervención coronaria percutánea. IVUS: ecografía intravascular. RFF: reserva fraccional de flujo. TCI: tronco coronario izquierdo.
INTRODUCCIÓN
La enfermedad significativa del tronco coronario izquierdo (TCI) se encuentra en un 4-5% de todas las coronariografías1. Dado que el TCI aporta más del 75% del flujo sanguíneo miocárdico total, el riesgo asociado a sus lesiones es el más alto de todas las posibles lesiones coronarias. Sin revascularización, el pronóstico es infausto, con una mortalidad del 37% a 3 años2. La revascularización puede ser quirúrgica o percutánea, cada una de ellas con sus ventajas y limitaciones. La adecuada valoración de la extensión anatómica y la complejidad de la enfermedad coronaria, la comorbilidad del paciente y el dominio de las técnicas de intervención coronaria percutánea (ICP) complejas son los factores más decisivos para elegir la estrategia de revascularización idónea. Existen diversos modelos y escalas para guiar la selección del paciente, sin que ninguno de ellos se haya impuesto claramente3,4.
PERSPECTIVA HISTÓRICA
La cirugía de revascularización aortocoronaria (CABG, coronary artery bypass surgery) ha sido el tratamiento estándar para los pacientes con enfermedad del TCI, basándose en los estudios clínicos iniciales que demostraron el beneficio pronóstico en pacientes asignados a cirugía frente a terapia médica5. Los pacientes con enfermedad grave del TCI fueron excluidos de la mayoría de los primeros estudios y hasta hace pocos años no existía ninguno específico cuyo objetivo principal fuera comparar los resultados de la cirugía frente a la ICP6,7. Actualmente ya se dispone de estudios clínicos aleatorizados que han refrendado la utilidad de la ICP en la enfermedad del TCI; tanto es así que las guías clínicas americanas y europeas la posicionan como la estrategia recomendada en escenarios concretos8,9. Aproximadamente el 50% de este tipo de lesiones se revascularizan percutáneamente en nuestro medio, con un 5% de incremento anual10.
RECUERDO ANATÓMICO
Anatómicamente, el TCI se divide en tres porciones, ostial, media y distal; esta última es una bifurcación con un ángulo típicamente más amplio que el de otras bifurcaciones coronarias (> 70°). Aporta al menos el 75% del flujo coronario total. El calibre habitual del TCI es de 5 ± 0,5 mm11 y su longitud media es de 10,5 ± 5,3 mm12. Hasta en un 30% de los casos da origen a una tercera rama, el ramo intermedio o bisectriz (figura 1).
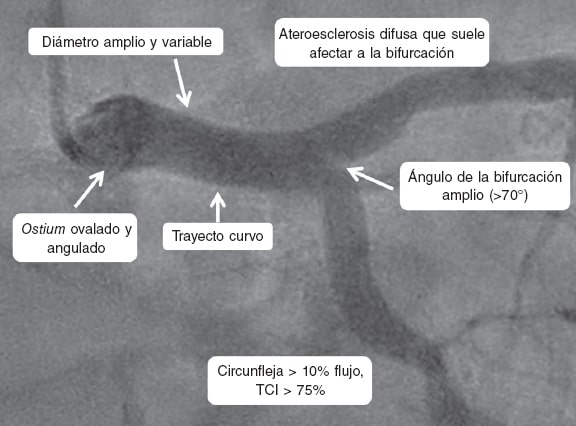
Figura 1. Características anatómicas principales del tronco coronario izquierdo (TCI).
La enfermedad ateroesclerótica del TCI suele ser difusa. Cuando la bifurcación está afectada (en un 70% de los casos) también suele haber placa en el origen de la arteria coronaria descendente anterior (DA) y de la arteria coronaria circunfleja (Cx)11. En ocasiones, la DA y la Cx presentan un origen independiente desde el seno coronario izquierdo, sin que exista propiamente TCI (0,41-0,67% de los casos)13,14. En un 0,03% de los pacientes, el TCI presenta un origen anómalo con un trayecto entre la aorta y la arteria pulmonar, patrón que se asocia con un riesgo elevado de muerte súbita14,15.
VALORACIÓN DEL TRONCO CORONARIO
Angiografía
Las guías de práctica clínica de la Sociedad Europea de Cardiología establecen que la revascularización del TCI está indicada para pacientes con estenosis angiográfica > 50% e isquemia miocárdica documentada16. El problema práctico es que la coronariografía presenta limitaciones para la valoración de la enfermedad del TCI, con una gran variabilidad intraobservador e interobservador17,18. Algunas lesiones ostiales pueden sobreestimarse debido a la superposición y artefacto del catéter o a un espasmo asociado, y las lesiones distales pueden ser difíciles de valorar debido a la afectación normalmente difusa de la bifurcación y la falta de vaso «sano» de referencia. La amortiguación o la ventricularización de la curva de presión son datos indirectos de afectación del TCI19.
Resulta imprescindible una correcta valoración de la gravedad del TCI dada la evidencia de que las lesiones funcionalmente no significativas presentan un pronóstico favorable sin revascularización20, así como del fallo precoz del injerto en lesiones no significativas21. A este respecto, las guías clínicas reconocen el valor de técnicas diagnósticas como la ecografía intravascular (IVUS, intravascular ultrasound) y la guía de presión en la estimación de la gravedad de la enfermedad del TCI.
Imagen intracoronaria
La IVUS permite obtener información acerca de la estructura y la anatomía del TCI , así como de la presencia de placa y su extensión, composición y calcificación. Diversos estudios han determinado un área luminal mínima (ALM) de > 6 mm² como punto de corte para determinar la gravedad22,23. El estudio español multicéntrico prospectivo LITRO demostró la seguridad de diferir la revascularización de las lesiones del TCI intermedias con ALM > 6 mm², con resultados favorables a 2 años de seguimiento24. Además, la IVUS ayuda a determinar si los ostia de la DA y la Cx presentan enfermedad significativa. Cuando está indicada la revascularización, orienta sobre el tamaño adecuado del stent y sobre la mejor estrategia en función de la anatomía y la carga de calcio del TCI y de la DA/Cx proximales; en lesiones por reestenosis de un stent previo, ayuda a caracterizar su etiología y la posible afectación de los bordes del stent. Realizar la ICP del TCI guiada con IVUS proporciona un beneficio en comparación con la ICP guiada por angiografía25. También puede valorar la necesidad de posdilatación del stent y la existencia de disección distal, y ayuda a determinar la necesidad de implante de un stent en la rama lateral o a excluir el compromiso de esta tras un stent provisional26. Se han descrito diversos parámetros que permiten optimizar la ICP del TCI mediante IVUS (figura 2 y figura 3). Un amplio metanálisis de pacientes de varios registros españoles ha mostrado que el uso de IVUS se asocia a una mejor evolución clínica, con reducción del objetivo de muerte e infarto, y también específicamente de la trombosis de los stents. Estos hallazgos resultaban especialmente significativos en las lesiones distales del tronco27. Otros registros y algún ensayo menor, así como el análisis conjunto de todos ellos, muestran el beneficio clínico significativo del uso de IVUS en la ICP del TCI, con reducción de muerte, infarto y trombosis28. Las guías de práctica clínica de la Sociedad Europea de Cardiología consideran como indicación IIa B el empleo de IVUS para estratificar la gravedad de toda lesión del TCI16.
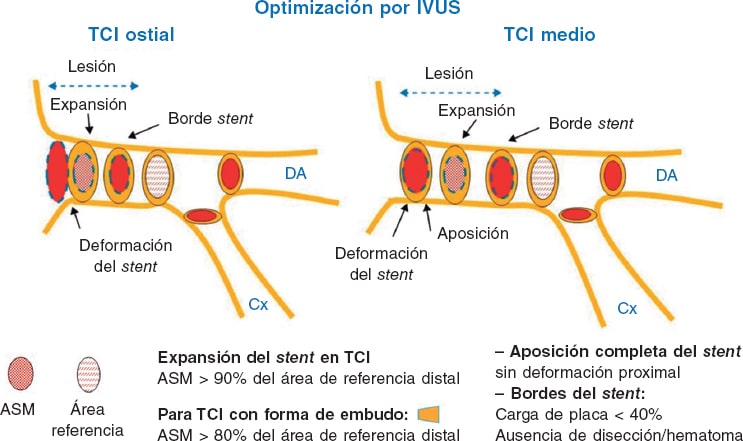
Figura 2. Puntos clave para la optimización de la intervención coronaria percutánea de las porciones ostial y media del tronco coronario izquierdo mediante ecografía intravascular. ASM: área stent mínima; Cx: circunfleja; DA: descendente anterior; IVUS: ecografía intravascular; TCI: tronco coronario izquierdo. (Modificada con permiso de de la Torre Hernández et al.25.)
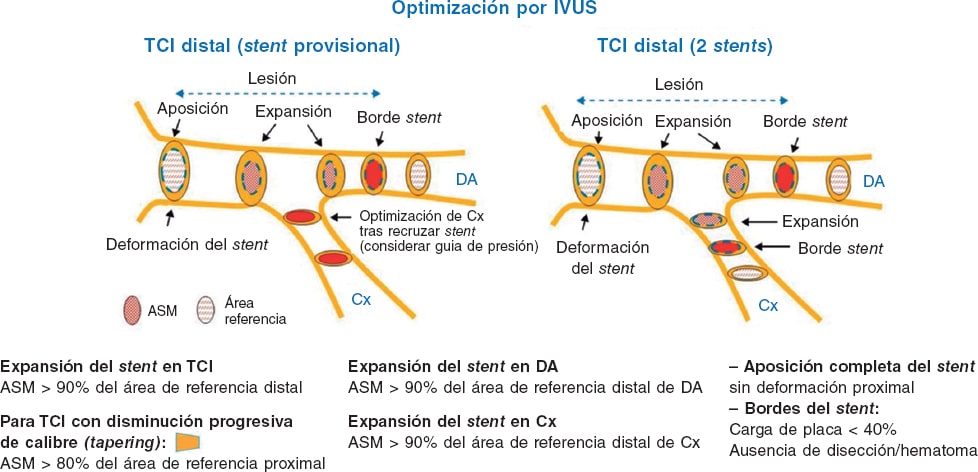
Figura 3. Puntos clave para la optimización de la intervención coronaria percutánea del tronco coronario izquierdo distal mediante ecografía intravascular. ASM: área stent mínima; Cx: circunfleja; DA: descendente anterior; IVUS: ecografía intravascular; TCI: tronco coronario izquierdo. (Modificada con permiso de de la Torre Hernández et al.25.)
La utilidad de la tomografía de coherencia óptica (OCT) en el TCI es algo más limitada, principalmente por la dificultad técnica de relleno completo con contraste y el área nativa de los segmentos ostiales. Otro inconveniente de su uso en el TCI es su profundidad de penetración limitada (2-3 mm) comparada con la de la IVUS (4-8 mm), y dado que el TCI suele presentar diámetros de 3,5-4,5 mm puede producirse una inadecuada valoración. Además, no se ha demostrado el valor de ningún punto de corte de ALM con OCT para el abordaje de las lesiones del TCI. Por otro lado, debido a las diferencias en la obtención de imágenes con ambas técnicas, los umbrales establecidos como puntos de corte en la IVUS no son extrapolables para la OCT.
Guía de presión
La guía de presión aporta información valiosa para estratificar la gravedad de la enfermedad del TCI16,29. Para evitar que una presumible enfermedad ostial afecte la medición, las presiones se han de ecualizar y medir con el catéter guía parcialmente «desintubado» del TCI. La obtención de índices de hiperemia, tanto desde la DA como desde la Cx, puede suponer una mejor valoración global de la gravedad de la enfermedad del TCI y una mayor seguridad en el momento de decidir el manejo. Algunos autores sugieren que, para asegurar la máxima hiperemia, la adenosina intravenosa es preferible a la intracoronaria4.
Otro aspecto importante de la valoración del TCI con guía de presión es la interdependencia fisiológica del árbol coronario, que puede alterar los valores de reserva fraccional de flujo (RFF). En particular, se ha descrito una sobreestimación de la RFF en presencia de enfermedad difusa de la DA y la Cx, así como una infraestimación en caso de enfermedad significativa de la rama lateral30. Por ello, ante una enfermedad concomitante de ramas distales, puede ser útil la medición de la RFF durante una retirada controlada30.
En cuanto al umbral patológico, parece que diferir la ICP con un valor de RFF > 0,8 es seguro31. Aunque el valor de otros índices de guía de presión que no requieren hiperemia, como el instantaneous wave-free ratio (iFR), no ha sido ampliamente evaluado en el TCI, un estudio ha demostrado la seguridad del uso del iFR para diferir la revascularización del TCI32. En la actualidad se está desarrollando en España el estudio multicéntrico iLITRO (NCT03767621), que probablemente arrojará luz sobre la utilidad del iFR y su umbral patológico en las lesiones del TCI.
Integración de técnicas
Es aconsejable integrar el uso de la IVUS y la guía de presión en la valoración del TCI de dudosa gravedad angiográfica, tal como se recomienda en un documento internacional de consenso de la European Association of Percutaneous Cardiovascular Interventions33 (figura 4). Así, en las lesiones ambiguas del TCI, un ALM > 6 mm2 indicaría no revascularizar, un ALM < 4,5-5 mm2 indicaría revascularizar y valores de ALM entre 4,5-5 y 6 mm2 harían recomendable el uso de la RFF/iFR para decidir.
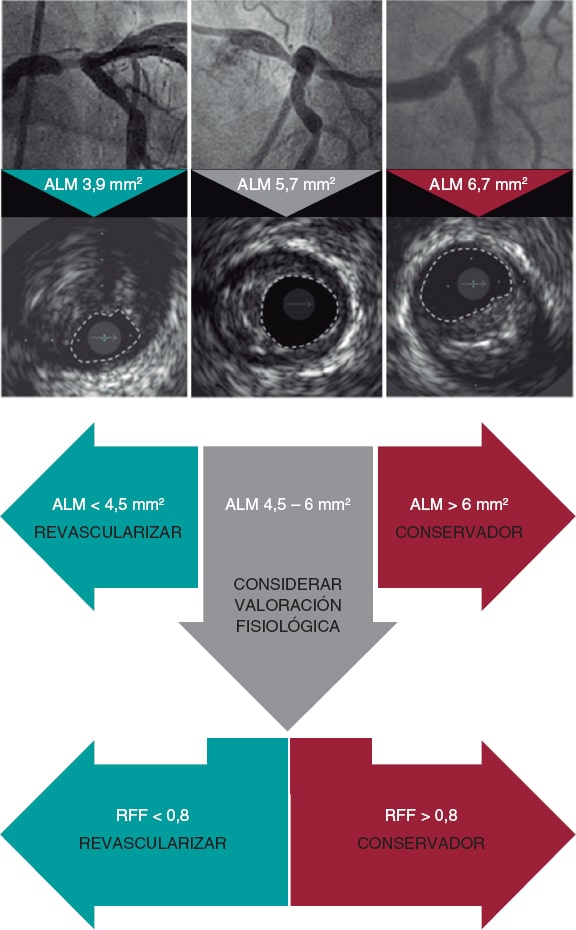
Figura 4. Criterios de enfermedad significativa de lesiones del tronco coronario izquierdo. ALM: área luminal mínima; RFF: reserva fraccional de flujo. (Modificada de Johnson et al.33.)
REVASCULARIZACIÓN DEL TRONCO COMÚN
Revascularización quirúrgica
El CABG ha sido el tratamiento estándar para los pacientes con enfermedad del TCI desde los ensayos clásicos que demostraron el beneficio pronóstico en pacientes aleatorizados a cirugía frente a terapia médica5. El registro CASS comunicó una tasa de supervivencia a 4 años en pacientes operados del 88%, frente al 63% en los no revascularizados34. Otros estudios demostraron una reducción de la mortalidad del 65% a favor de la cirugía35. Esta permite una revascularización completa independientemente de las características de la lesión proximal, y los avances técnicos permiten procedimientos cada vez más rápidos sin necesidad de bomba extracorpórea. La principal desventaja sigue siendo la aún no despreciable morbimortalidad perioperatoria y posoperatoria. Algunos estudios han objetivado una tasa de muerte del 5,5-8,5%, de necesidad de revascularización guiada por isquemia del 7,1-9,4% y de ictus del 3,1-5,1% a 3 años36.
Revascularización percutánea
La introducción de los stents supuso una importante mejora de los resultados de la ICP sobre el TCI, aunque en un primer momento, utilizando stents convencionales, mostró peores resultados que la cirugía, con tasas de mortalidad del 14% con una fracción de eyección del ventrículo izquierdo (FEVI) > 40% y del 78% con FEVI < 40% a los 9 meses37. Con la llegada del stent farmacoactivo, las tasas de reestenosis y de eventos adversos disminuyeron lo suficiente como para equiparar la ICP con la CABG38-41, con tasas de supervivencia libre de eventos al año del 98% en pacientes con FEVI < 40%38. En pacientes rechazados para cirugía (EuroSCORE > 6 o Parsonnet > 15), las tasas de mortalidad y de supervivencia sin eventos cardiovasculares adversos mayores fueron del 3,5% y el 75,3%, respectivamente, a 6 meses42. Estos trabajos ya indicaban que la ICP sobre las porciones del TCI ostial y media parecía tener un mejor pronóstico que la ICP del TCI distal o la que implicaba bifurcación. La aparición de nuevos fármacos antiproliferativos, el desarrollo de mejores dispositivos y la realización de nuevas técnicas y estrategias en el tratamiento de las bifurcaciones han permitido mejorar los resultados, la eficacia y el buen pronóstico de la ICP sobre el TCI en centros con amplia experiencia.
Revascularización quirúrgica frente a percutánea
Han sido 6 los principales ensayos aleatorizados que han confrontado la estrategia percutánea con la quirúrgica (tabla 1 ). Los primeros (LE MANS43, SYNTAX44, Boudriot et al.45 y PRECOMBAT46) se realizaron con stents farmacoactivos de primera generación y comunicaron tasas similares del combinado de muerte, infarto y accidente cerebrovascular para ambas estrategias. Las principales diferencias fueron una mayor incidencia de accidente cerebrovascular en el grupo de CABG y una mayor tasa de necesidad de nueva revascularización tras la ICP. Los dos ensayos más recientes, los estudios EXCEL y NOBLE, emplearon stents farmacoactivos de segunda generación e incluyeron cohortes amplias de pacientes con enfermedad ateroesclerótica menos compleja, lo que quizás refleja mejor la práctica clínica real16,47. El distinto resultado que obtuvieron estos dos estudios suscitó mucha polémica, destacando las diferencias en la definición del objetivo primario y de infarto periprocedimiento como posibles condicionantes. Y es que el estudio NOBLE, al contrario que el EXCEL, excluyó el infarto periprocedimiento del combinado de eventos primario, a pesar de que su inclusión está recomendada por el Academic Research Consortium y forma parte de la definición universal de infarto de miocardio. Se ha demostrado que el infarto periprocedimiento asocia un peor pronóstico16. Por su parte, la amplia diferencia en la tasa de trombosis del stent (0,7% en el EXCEL frente a 3% en el NOBLE) apunta a la posible influencia del distinto tipo de stent que se empleó en cada estudio.
Tabla 1. Principales estudios comparativos entre revascularización percutánea y quirúrgica
| Estudio | Año | n | SYNTAX medio | Lesiones del TCI distal | Tipo de stent | Objetivo primario (ICP frente a CABG) | Objetivos secundarios (ICP frente a CABG) |
|---|---|---|---|---|---|---|---|
| LE MANS43 | 2008 | 105 | n/a | 58% | Convencional, stents recubiertos de primera generación | Cambio en FEVI a 1 año: 3,3 ± 6,7% frente a 0,5 ± 0,8%; p = 0,047 |
|
| SYNTAX LM44 | 2010 | 705 | 30 | 61% | Taxus | Muerte, ACV, IM o necesidad de revascularización a 1 año: 15,8% frente a 13,6%; p = 0,44 |
|
| Boudriot el al.45 | 2011 | 201 | 23 | 72% | Cypher | Muerte, IM o necesidad de revascularización a 1 año: 19,0% frente a 13,9%; p no inferioridad = 0,19 |
|
| PRECOMBAT46 | 2011 | 600 | 25 | 64% | Cypher | Muerte, ACV, IM, ID-TLR a 1 año: 8,7% frente a 6,7%; p no inferioridad = 0,01 |
|
| EXCEL16 | 2017 | 1.905 | 21 | 81% | Xience | Muerte, ACV o IM a 3 años: 15,4% frente a 14,7%: p no inferioridad = 0,02; p superioridad = 0,98 |
|
| NOBLE38 | 2017 | 1.201 | 22 | 81% | BioMatrix Otros stents recubiertos | Muerte, ACV, IM periprocedimiento o necesidad de revascularización a 5 años: 29% frente a 19%; p = 0,0066 |
|
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; ID-TLR: revascularización guiada por isquemia (ischaemia-driven target lesion revascularization); FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; n/a: no aplicable; TCI: tronco coronario izquierdo. | |||||||
En general, los resultados de estos estudios señalan que, siempre que se consiga la revascularización completa, la cirugía y la ICP logran resultados equivalentes para el combinado de muerte, infarto e ictus a 5 años de seguimiento48. No obstante, existe un beneficio temprano para la ICP en términos de infarto e ictus periprocedimiento, que se neutraliza por un mayor riesgo de infarto durante el seguimiento a largo plazo. El riesgo de necesidad de nueva revascularización sí es uniformemente mayor en los pacientes con ICP comparados con los tratados con cirugía.
Otro punto que hay que considerar es la relación entre los resultados de la ICP y la puntuación en la escala SYNTAX. Con los primeros ensayos ya se sugirió que una mayor puntuación probablemente se asociaba a un mejor pronóstico con el CABG. Algunos metanálisis han comunicado que, en conjunto, la mortalidad por causa cardiaca a largo plazo parece ser directamente proporcional a la complejidad angiográfica de la enfermedad del TCI. Así, los pacientes con una puntuación SYNTAX baja presentaron mejor pronóstico con ICP que los pacientes con una puntuación alta. Además, los pacientes con una puntuación SYNTAX alta presentaron una tendencia no significativa hacia una mayor supervivencia a 10 años con cirugía en comparación con ICP49,50. Uno de los principales inconvenientes de esta escala es que solo integra variables anatómicas. En la actualidad se dispone de otras escalas que combinan variables angiográficas, clínicas e incluso funcionales, pero su utilidad como marcadores de pronóstico a largo plazo en la enfermedad del TCI no ha sido debidamente evaluada51.
Las actuales guías de revascularización coronaria16 establecen la indicación de CABG o ICP en función de la puntuación SYNTAX (tabla 2). Si la complejidad es baja, la ICP del TCI está tan indicada como la cirugía (IA). La ICP es una alternativa a la cirugía en los pacientes con una puntuación SYNTAX intermedia (IIa A), y se necesita una mayor evidencia en aquellos con puntuación SYNTAX alta para recomendar claramente la ICP.
Tabla 2. Indicación, nivel y clase de evidencia de la enfermedad significativa de tronco coronario izquierdo según las guías de revascularización miocárdica de la Sociedad Europea de Cardiología 20188
| Enfermedad de tronco coronario izquierdo | Cirugía | ICP | ||
|---|---|---|---|---|
| SYNTAX bajo (0-22) | I | A | I | A |
| SYNTAX intermedio (23-32) | I | A | IIa | A |
| SYNTAX alto (≥ 33) | I | A | III | B |
Selección de los pacientes
Las guías europeas destacan la importancia de un equipo multidisciplinario en la decisión de la estrategia de revascularización en pacientes estables con enfermedad del TCI. El equipo debe estar constituido por cardiólogos clínicos e intervencionistas y cirujanos cardiacos. En cambio, en procedimientos emergentes, la cirugía no suele ser una opción factible por el retraso que supone y el empeoramiento progresivo del pronóstico en relación con el tiempo de isquemia. Pappalardo et al.52 comunicaron una mortalidad intrahospitalaria del 21% (principalmente por fallo multiorgánico) en pacientes con infarto agudo de miocardio y oclusión aguda del TCI. Sin embargo, los pacientes que sobrevivieron al ingreso y que fueron tratados con ICP presentaron buen pronóstico, con una supervivencia del 89,5% al año.
En el resto de los supuestos sería deseable no realizar el intervencionismo ad hoc tras el procedimiento diagnóstico. Deberían discutirse con el cardiólogo clínico, el cirujano cardiaco y especialmente el paciente las diferentes opciones de revascularización, informando a este de manera objetiva sobre las ventajas y los inconvenientes teóricos de cada técnica y los resultados particulares de su centro, haciéndole partícipe en la decisión. También hay que tener en cuenta otros factores clínicos, anatómicos y generales (tabla 3). Si se decide que la ICP del TCI es la mejor opción, una adecuada premedicación, la revisión en equipo y la planificación del procedimiento en cuanto a técnica y materiales conllevan una mayor tasa de éxito.
Tabla 3. Factores influyentes en la modalidad de revascularización del tronco coronario izquierdo
| A favor de la ICP | A favor de la CABG | |
|---|---|---|
| Factores generales |
|
|
| Factores clínicos |
|
|
| Factores anatómicos |
|
|
| Preferencias y necesidades del paciente | ||
CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble; TCI: tronco coronario izquierdo. | ||
Debido a que la mayoría de los ensayos clínicos se han realizado en centros con cirugía cardiaca, la realización de la ICP del TCI en centros sin cirugía ha estado en entredicho. No obstante, dado que existe evidencia del buen resultado de la ICP en centros sin cirugía53-55, se acepta que la ICP del TCI puede realizarse en estos centros con seguridad, siempre que se disponga de un equipo médico experimentado y de equipamiento técnico suficiente, con consentimiento informado del paciente y un protocolo previo bien establecido para el traslado urgente a un hospital con cirugía cardiaca en el hipotético caso de que se precisase una cirugía emergente.
Equipo médico y técnico
La ICP del TCI siempre debe considerarse un procedimiento de alto riesgo, en el que la experiencia de los operadores desempeña un papel fundamental. Hay evidencia de que los pacientes tratados en centros con un alto número de procedimientos de este tipo tienen mejor pronóstico56.
El equipamiento debe garantizar, por un lado, la correcta valoración del TCI (IVUS, guía de presión), y por otro la disponibilidad de todo tipo de material que pudiera ser necesario para la angioplastia y sus posibles complicaciones. Por ser un procedimiento de alto riesgo, los medios y los dispositivos de soporte hemodinámico, como el balón de contrapulsación intraaórtico y el Impella (Abiomed, Estados Unidos), ocupan un lugar importante.
LA ANGIOPLASTIA DEL TRONCO CORONARIO IZQUIERDO
Previamente al procedimiento es fundamental un estudio completo del caso para decidir la estrategia, la vía de acceso (radial o femoral), el calibre del introductor (por la presumible necesidad de técnica de 2 stents se recomiendan catéteres de 7 Fr por vía femoral o «7 en 6 Fr» por vía radial) y el tipo de catéter guía. Aunque el intervencionismo por vía radial ha desplazado en numerosos escenarios al femoral, probablemente la ICP sobre el TCI sea un nicho en el que el acceso femoral deba ser considerado, dado que conseguir el mejor apoyo posible puede ser clave y que permite el uso de catéteres de mayor calibre y la posibilidad de un implante rápido de un dispositivo de soporte hemodinámico.
La afectación del TCI distal o de la bifurcación implica que el procedimiento sea más complejo, con mayor probabilidad de necesidad de doble stent y peor pronóstico. Otros factores asociados a peor resultado y mal pronóstico son la calcificación y el pequeño diámetro del TCI, y la presencia de enfermedad no ostial en la DA o la Cx57.
Posicionamiento de guías (wiring) y preparación de la lesión
El empleo de al menos 2 guías de angioplastia (para las 2 ramas principales) será la norma en la ICP del TCI, con notables excepciones como son las lesiones del TCI protegido, si se precisa realizar rotablación o en algunos casos de enfermedad del TCI aislada y ostial. El uso de la doble guía modifica ligeramente el ángulo de la bifurcación, lo que facilita el acceso a la rama lateral y ayuda a mantener el flujo hacia esta. También posibilita localizarla en caso de oclusión, y algunos autores defienden la técnica de rescate con balón si se compromete el flujo tras el implante del stent en la rama principal58. Se debe evitar la predilatación del vaso principal sin haber protegido ambas ramas, debido al alto riesgo de modificar y desplazar la placa, que puede ocluir el ostium de alguna rama y dificultar su sondaje posterior.
Se puede considerar el empleo de técnicas de descarga de placa (rotablación o láser, entre otras) para modificar la anatomía y facilitar la angioplastia. Las lesiones ostiales del TCI suelen presentar abundante calcificación y gran cantidad de fibras musculares elásticas, lo que comporta un riesgo de retracción elástica de la lesión tanto tras la predilatación como tras el implante del stent. Por otra parte, la presencia de placas fibrocalcificadas suele condicionar el empleo de balones de corte como primer paso e incluso de rotablación, la cual ha demostrado ser beneficiosa en la angioplastia del TCI bifurcado previa al implante de un stent farmacoactivo59,60. En cuanto a la rama lateral, cuando presenta enfermedad grave ostial o muy calcificada, o cuando el acceso a ella ha sido muy dificultoso, se recomienda su predilatación con balones no distensibles y de pequeño tamaño.
Elección del stent
Al elegir el tamaño del stent deben diferenciarse 2 escenarios: que se vaya a tratar exclusivamente el TCI o que sea preciso tratar la bifurcación. Solo en casos de enfermedad ostial y medial aislada puede estar justificado tratar solo el TCI, y en tal situación debería escogerse un stent de tamaño nominal lo más cercano posible al tamaño del TCI. Otra opción es implantar un stent de tamaño inferior y sobreexpandirlo con un balón de alta presión de las dimensiones adecuadas. Diversas plataformas consiguen amplios grados de expansión sin que se pierda la integridad de su estructura61,62. Sin embargo, no existe evidencia acerca de si la sobreexpansión es una práctica segura, puesto que se expone a una cobertura subóptima de la íntima debido a la disminución de la ratio metal/arteria, y además podrían alterarse el polímero o la cinética de la liberación del fármaco del stent.
Cuando hay que tratar la bifurcación, el stent del TCI debe cubrir la porción proximal de una de las dos ramas principales, y su tamaño debe adecuarse al diámetro proximal de esa rama principal. Un aspecto fundamental es la necesidad posterior de realizar una optimización (POT, proximal optimisation technique) con un balón no distensible para adaptar el calibre proximal del stent al TCI, y en caso de que sea preciso, facilitar recruzar a la rama lateral o realizar la técnica de doble stent.
Los stents en el TCI están especialmente expuestos a una deformación proximal debido al continuo contacto con el catéter guía, la necesidad de POT y el roce con otros dispositivos que precisen pasar a su través una vez implantados63. Por tanto, la resistencia de cada stent a la compresión longitudinal es un parámetro que se debería tener en cuenta al seleccionar un stent. Otras características fundamentales que hay que considerar con el fin de elegir el stent ideal para la ICP del TCI son su perfil de seguridad y su precisión (figura 5).
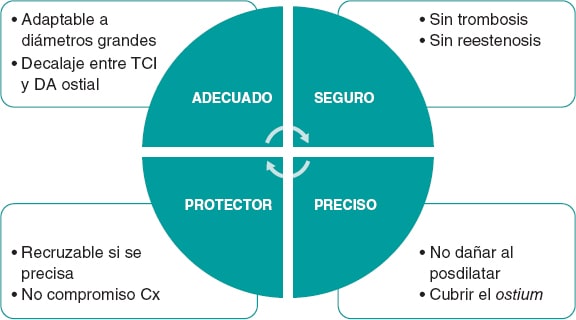
Figura 5. Características técnicas del stent ideal para la intervención coronaria percutánea del tronco coronario izquierdo. Cx: circunfleja; DA: descendente anterior; TCI: tronco coronario izquierdo.
Selección de la técnica de bifurcación
Bifurcación no compleja
Cuando la enfermedad del TCI afecta una sola rama de la bifurcación o la Cx presenta un pequeño calibre (< 2,5 mm), la mejor estrategia es el stent provisional con un stent único desde el TCI hasta la rama principal. En general, la DA es la rama principal, mientras que solo en algunos casos sería la Cx. Posteriormente, la POT con balón no distensible de tamaño adecuado está recomendada de manera sistemática.
En numerosas ocasiones es necesario cubrir por completo la longitud del TCI, y es importante ser muy preciso al implantar el stent para no dejar sin tratar de manera adecuada el ostium ni que sobresalga significativamente el stent en la aorta.
Hay controversia acerca de si es necesario recruzar siempre hacia la rama lateral y optimizar con kissing balloon en la bifurcación después de realizar la POT, en caso de que el stent provisional parezca ser suficiente. El kissing balloon sí debe hacerse siempre que el resultado final sea subóptimo en la rama lateral, cuando la rama principal seleccionada haya sido la Cx y cuando no se pueda descartar la necesidad de ICP sobre la rama lateral en el futuro4.
Bifurcación compleja
Cuando la enfermedad afecta significativamente a ambas ramas de la bifurcación, se debe considerar el empleo de una técnica de doble stent. Sin embargo, dado que diversos registros comunican que las tasas de reestenosis y de nueva revascularización son menores con el empleo de un solo stent38,64-66, el abordaje inicial en muchos centros y en la mayoría de las bifurcaciones complejas suele ser el stent provisional con la posibilidad de acabar realizando una técnica de doble stent si finalmente es preciso. Cuando el resultado es subóptimo, el comité de expertos del European Bifurcation Group recomienda la realización de una técnica de doble stent en T, T and mall protrusion (TAP) o culotte como rescate tras el stent provisional67. Una vez implantado el segundo stent en la rama lateral, se recomienda la dilatación individual en ambas ramas con balones no distensibles para asegurar la expansión ostial del stent de DA y Cx, seguida de kissing balloon. Si este abarca un segmento considerable del TCI, se deberá realizar una nueva dilatación proximal (re-POT) que optimice el resultado.
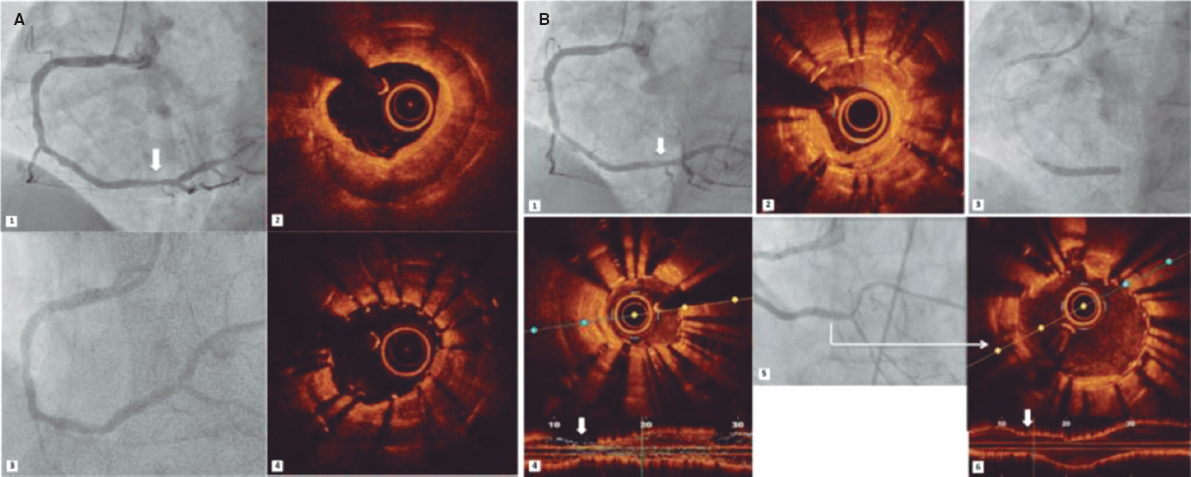
Cuando se decide de inicio realizar una técnica de doble stent, la elección dependerá de diversos factores: las variables anatómicas y angiográficas, la localización de la lesión, las técnicas de imagen intracoronaria, la afectación de los ostia de la DA y la Cx, la situación clínica e incluso el dominio de cada técnica por parte del operador. A día de hoy no se dispone de evidencia suficiente para considerar una determinada técnica mejor que las demás. Se han descrito varios algoritmos y estrategias de tratamiento en función de estos parámetros, como el de Fajadet et al.68 o el de De Maria y Banning69. Sin embargo, ninguno ha conseguido imponerse de manera clara, probablemente debido a la enorme variabilidad de situaciones clínicas y angiográficas, y a la diferente experiencia en los distintos centros. En la actualidad, las técnicas de crush, crush modificado y culotte siguen siendo las más habituales. El doble kissing crush parece tener buenos resultados, pues se ha asociado a una reducción de la tasa de fallo de la lesión tratada y de trombosis del stent a 3 años (figura 6)70.
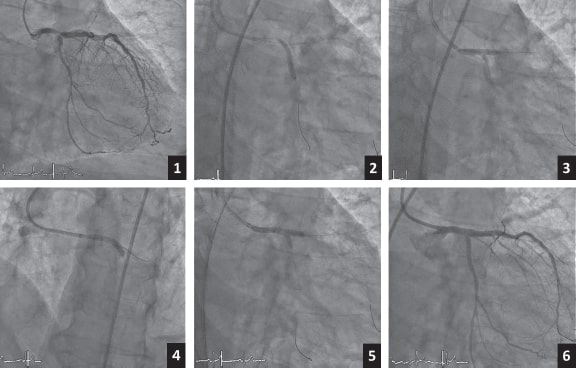
Figura 6. Ejemplo de doble kissing chrush. 1: angiografía basal. 2: stent implantado hacia la circunfleja. 3: primer inflado en kissing balloon. 4: stent hacia la descendente anterior. 5: segundo inflado en kissing balloon. 6: angiografía con el resultado final.
Optimización del resultado
La IVUS, la OCT y la guía de presión permiten optimizar el resultado de la angioplastia del TCI. Hay evidencia de que un resultado subóptimo de la angioplastia del TCI se asocia a un peor pronóstico clínico71. Si bien la OCT presenta las limitaciones antes expuestas (menos profundidad de imagen que la IVUS, posible relleno inadecuado), lo cierto es que ambas técnicas pueden detectar hallazgos relevantes, como la infraexpansión del stent, la malaposición de struts, la disección de bordes y el grado de compromiso de la rama lateral, que podrían requerir una optimización del resultado.
La herramienta para la que se dispone de más evidencia en la optimización del resultado de la angioplastia del TCI también es la IVUS, a la que se le reconoce un beneficio clínico neto26,72,73. El uso protocolizado de IVUS con el objetivo de una optimización parece que mejora adicionalmente el pronóstico de estos pacientes30. No obstante, un estudio en curso, el OPTIMAL (NCT04111770, Optimization of left main percutaneous coronary intervention with intravascular ultrasound randomized controlled trial), en el que se pretende incluir 800 pacientes, permitirá conocer el efecto pronóstico del uso de la IVUS en la ICP del TCI, frente al uso de angiografía sola.
Por su parte, la guía de presión cuenta con estudios acerca de su valor como predictor de eventos en caso de stent provisional, al estimar la reserva de flujo hacia la rama lateral74.
TRATAMIENTO MÉDICO TRAS LA INTERVENCIÓN CORONARIA PERCUTÁNEA Y SEGUIMIENTO
A pesar de que la angioplastia sobre la bifurcación es un predictor de eventos54,75, actualmente no hay evidencia para recomendar un régimen de tratamiento antiagregante específico en la angioplastia del TCI. Por tanto, el tratamiento debe pautarse en función de la presentación clínica y del perfil de riesgo isquémico y hemorrágico de cada paciente. Ahora bien, hay que tener en cuenta que el implante de stent en el TCI y la ICP sobre la bifurcación, principalmente si se emplean 2 stents, son criterios que añaden un mayor riesgo isquémico al perfil de estos pacientes76-79.
La reaparición de síntomas sugestivos o de isquemia documentada justifica un manejo invasivo. La coronariografía de revisión durante el primer año en pacientes con angioplastia del TCI tiene una indicación IIB C en las guías europeas16, y no está justificada en todos los casos. El ensayo aleatorizado ANGELINE (evaluación angiográfica después de la intervención percutánea del tronco) (NCT04604197) arrojará evidencias respecto a las potenciales ventajas de la revisión angiográfica sistemática.
CONCLUSIONES
La valoración de las lesiones del TCI resulta compleja, y es recomendable la realización de diferentes proyecciones angiográficas y el empleo de otras herramientas, como la IVUS o la guía de presión.
Actualmente, la puntuación SYNTAX, la posibilidad de una revascularización completa y la comorbilidad del paciente son los criterios principales que deben guiar la selección de una revascularización percutánea o quirúrgica.
En cuanto a la ICP sobre la lesión del TCI, se distinguen 2 grupos: las lesiones aisladas del TCI ostial o medio, que son técnicamente más sencillas de tratar y con excelente pronóstico, y las lesiones que comprenden la bifurcación, que tienen un abordaje más complejo.
Es fundamental la optimización de los procedimientos de ICP sobre el TCI, usando imagen intravascular, así como técnicas y stents que cuenten con las mayores evidencias en este contexto, y una adecuada cobertura farmacológica posterior.
En suma, la ICP en las lesiones del TCI sin duda hace mucho que cruzó su particular Rubicón. La suerte está echada (alea jacta est) y, en el futuro, los nuevos estudios aleatorizados sobre revascularización quirúrgica o percutánea y los avances técnicos en ambas modalidades serán los que decidan hacia qué lado se decanta la balanza. Mientras tanto, la práctica de una revascularización centrada en cada paciente concreto y la colaboración estrecha en el equipo multidisciplinario deben guiar la actuación de los cardiólogos clínicos e intervencionistas y de los cirujanos cardiacos.
FINANCIACIÓN
No se declara ninguna.
CONFLICTO DE INTERESES
Los autores no presentan conflictos de intereses al respecto del contenido del presente manuscrito.
BIBLIOGRAFÍA
1. Giannoglou GD, Antoniadis AP, Chatzizisis YS, et al. Prevalence of narrowing >or=50% of the left main coronary artery among 17,300 patients having coronary angiography. Am J Cardiol. 2006;98:1202-1205.
2. Taggart DP, Kaul S, Boden WE, et al. Revascularization for unprotected left main stem coronary artery stenosis stenting or surgery. J Am Coll Cardiol. 2008;51:885-892.
3. Garg S, Stone G, Kappetein AP, et al. Clinical and angio-graphic risk assessment in patients with left main stem stenosis. J Am Coll Cardiol Intv. 2010;3:891-901.
4. Lassen JF, Burzotta F, Banning AP, et al. Percutaneous coronary intervention for the left main stem and other bifurcation lesions:12th consensus document from the European Bifurcation Club. EuroIntervention. 2018;13:1540-1553.
5. Yusuf S, Zucker D, Peduzzi P, et al. Effect of coronary artery bypass graft surgery on survival:overview of 10-year results from randomized trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet. 1994;344:563-570.
6. Serruys PW, Unger F, Sousa JE, et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med. 2001;344:1117-1124.
7. Serruys PW, Onuma Y, Garg S, et al. 5-year clinical outcomes of the ARTS II (Arterial Revascularization Therapies Study II) of the sirolimus-eluting stent in the treatment of patients with multivessel de novo coronary artery lesions. J Am Coll Cardiol. 2010;55:1093-1101.
8. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on Myocardial Revascularization. Eur Heart J. 2019;40:87-165.
9. Patel MR, Calhoon JH, Dehmer GJ, et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease:A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. J Am Coll Cardiol. 2017;69:2212-2241.
10. Cid Álvarez AB, Rodríguez Leor O, Moreno R, Pérez de Prado A. Registro Español de Hemodinámica y Cardiología Intervencionista. XXVIII Informe Oficial de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología (1990-2018). Rev Esp Cardiol. 2019;72:1043-1053.
11. Oviedo C, Maehara A, Mintz GS, et al. Intravascular ultrasound classification of plaque distribution in left main coronary artery bifurcations:where is the plaque really located?Circ Cardiovasc Interv. 2010;3:105-112.
12. Medrano-Gracia P, Ormiston J, Webster M, et al. A computational atlas of normal coronary artery anatomy. EuroIntervention. 2016;12:845-854.
13. Yamanaka O, Hobbs RE. Coronary artery anomalies in 126.595 patients undergoing coronary arteriography. Cathet Cardiovasc Diagn. 1990;21:28-40.
14. Angelini P. Coronary artery anomalies:an entity in search of an identity. Circulation. 2007;115:1296-305.
15. Cheezum MK, Liberthson RR, Shah NR, et al. Anomalous aortic origin of a coronary artery from the inappropriate sinus of Valsalva. J Am Coll Cardiol. 2017;69:1592-1608.
16. Stone GW, Kappetein AP, Sabik JF, et al. Five-Year Outcomes after PCI or CABG for Left Main Coronary Disease. N Engl J Med. 2019;381:1820-1830.
17. Lindstaedt M, Spiecker M, Perings C, et al. How good are experienced interventional cardiologists at predicting the functional significance of intermediate or equivocal left main coronary artery stenosis?Int J Cardiol. 2007;120:254-261.
18. Fisher LD, Judkins MP, Lesperance J, et al. Reproducibility of coronary arteriographic reading in the coronary artery surgery study (CASS). Cathet Cardiovasc Diagn. 1982;8:565-575.
19. Kern MJ, Lim MJ, Boldstein JA. Hemodynamic Rounds:Interpretation of Cardiac Pathophysiology from Pressure Waveform Analysis. Oxford:John Wiley &Sons;2018. 342-343.
20. Kandzari DE, Colombo A, Park SJ, et al. Revascularization for unprotected left main disease:evolution of the evidence basis to redefine treatment standards. J Am Coll Cardiol. 2009;54:1576-1588.
21. Botman CJ, Schonberger J, Koolen S, et al Does stenosis severity of native vessels influence bypass graft patency?A prospective fractional flow reserve-guided study. Ann Thorac Surg. 2007;83:2093-2097.
22. Mintz GS, Lefèvre T, Lassen JF, et al. Intravascular ultrasound in the evaluation and treatment of left main coronary artery disease:a consensus statement from the European Bifurcation Club. EuroIntervention. 2018;14:e467-e474.
23. Kang SJ, Ahn JM, Song H. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
24. De la Torre Hernández JM, Hernández F, Alfonso F, et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study. J Am Coll Cardiol. 2011;58:351-358.
25. De la Torre Hernández JM, García Camarero T, Baz Alonso JA, et al. Outcomes of predefined optimisation criteria for intravascular ultrasound guidance of left main stenting. EuroIntervention. 2020;16:210-217.
26. Kang SJ, Ahn JM, Kim WJ. Functional and morphological assessment of side branch after left main coronary artery bifurcation stenting with cross-over technique. Catheter Cardiovasc Interv. 2014;83:545-552.
27. De la Torre Hernández JM, JoséAntonio Baz JA, Gómez Hospital JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease:pooled analysis at patient level of 4 registries. JACC Cardiovasc Interv. 2014;7:244-254.
28. Wang Y, Mintz GS, Gu Z, et al. Meta-analysis and systematic review of intravascular ultrasound versus angiography-guided drug eluting stent implantation in left main coronary disease in 4592 patients. BMC Cardiovasc Disord. 2018;18:115.
29. Ramadan R, Boden WE, Kinlay S. Management of Left Main Coronary Artery Disease. J Am Heart Assoc. 2018;7:e008151.
30. Modi BN, van de Hoef TP, Piek JJ, et al. Physiological assessment of left main coronary artery disease. EuroIntervention. 2017;13:820-827.
31. Hamilos M, Muller O, Cuisset T, et al. Long-term clinical outcome after fractional flow reserve-guided treatment in patients with angiographically equivocal left main coronary artery stenosis. Circulation. 2009;120:1505-1512.
32. Warisawa T, Cook CM, Rajkumar C, et al. Safety of Revascularization Deferral of Left Main Stenosis Based on Instantaneous Wave-Free Ratio Evaluation. JACC Cardiovasc Interv. 2020;13:1655-1664.
33. Johnson TW, Räber L, di Mario C, et al. Clinical use of intracoronary imaging. Part 2:acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making:an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2019;40:2566-2584.
34. Mock MB, Ringqvist I, Fisher LD, et al. Survival of medically treated patients in the coronary artery surgery study (CASS) registry. Circulation. 1982;66:562-568.
35. Yusuf S, Zucker D, Peduzzi P, et al. Effect of coronary artery bypass graft surgery on survival:overview of 10-year results from randomized trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet. 1994;344:563-570.
36. Modolo R, Chichareon P, Kogame N, et al. Contemporary Outcomes Following Coronary Artery Bypass Graft Surgery for Left Main Disease. J Am Coll Cardiol. 2019;73:1877-1886.
37. Ellis SG, Tamai H, Nobuyoshi M, et al. Contemporary percutaneous treatment of unprotected left main coronary stenosis:Initial results from a multicenter registry analysis 1994-1996. Circulation. 1997;96:3867-3872.
38. Park SJ, Kim YH, Lee BK, et al. Sirolimus-eluting stent implantation for unprotected left main coronary artery stenosis:Comparison with bare metal stent implantation. J Am Coll Cardiol. 2005;45:351-356.
39. Mehilli J, Kastrati A, Byrne R, et al. Paclitaxel- versus Sirolimus-eluting stents for unprotected left main coronary artery disease. J Am Coll Cardiol. 2009;53:1760-1768.
40. Valgimigli M, Chieffo A, Lefebre T, et al. Revisiting the incidence and temporal distribution of cardiac and sudden death in patients undergoing elective intervention for unprotected left main coronary artery stenosis in the drug eluting stent era. EuroIntervention. 2007;2:435-443.
41. Biondi-Zoccai GG, Lotrionte M, Moretti C, et al. A collaborative systematic review and meta-analysis on 1278 patients undergoing percutaneous drug-eluting stenting for unprotected left main coronary artery disease. Am Heart J. 2008;155:274-283.
42. Chieffo A, Stankovic G, Bonizzoni E, et al. Early and mid-term results of drug-eluting stent implantation in unprotected left main. Circulation. 2005;111:791-795.
43. Buszman PE, Buszman PP, Kiesz RS, et al. Early and long-term results of unprotected left main coronary artery stenting:the LE MANS (Left Main Coronary Artery Stenting) registry. J Am Coll Cardiol. 2009;54:1500-1511.
44. Morice MC, Serruys PW, Kappetein AP, et al. Outcomes in patients with de novo left main disease treated with either percutaneous coronary intervention using paclitaxel-eluting stents or coronary artery bypass graft treatment in the Synergy Between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery (SYNTAX) trial. Circulation. 2010;121:2645-2653.
45. Boudriot E, Thiele H, Walther T, et al. Randomized comparison of percutaneous coronary intervention with sirolimus-eluting stents versus coronary artery bypass grafting in unprotected left main stem stenosis. J Am Coll Cardiol. 2011;57:538-545.
46. Park SJ, Kim YH, Park DW, et al. Randomized trial of stents versus bypass surgery for left main coronary artery disease. N Engl J Med. 2011;364:1718-1727.
47. Holm NR, Mäkikallio T, Lindsay MM, et al. Percutaneous coronary angioplasty versus coronary artery bypass grafting in the treatment of unprotected left main stenosis:updated 5-year outcomes from the randomised, non-inferiority NOBLE trial. Lancet. 2020;395:191-199.
48. Giacoppo D, Colleran R, Cassese S, et al. Percutaneous coronary intervention vs coronary artery bypass grafting in patients with left main coronary artery stenosis:A systematic review and meta-analysis. JAMA Cardiol. 2017;2:1079-1088.
49. Palmerini T, Serruys P, Kappetein AP, et al. Clinical outcomes with percutaneous coronary revascularization vs coronary artery bypass grafting surgery in patients with unprotected left main coronary artery disease:A meta-analysis of 6 randomized trials and 4,686 patients. Am Heart J. 2017;190:54-63.
50. Rahouma M, Abouarab A, Di Franco A, et al. Percutaneous coronary intervention versus coronary bypass surgery for unprotected left main disease:a meta-analysis of randomized controlled trials. Ann Cardiothorac Surg. 2018;7:454-462.
51. Raber L, Juni P, Loffel L, et al. Impact of stent overlap on angiographic and long-term clinical outcome in patients undergoing drug-eluting stent implantation. J Am Coll Cardiol. 2010;55:1178-1188.
52. Pappalardo A, Mamas MA, Imola F, et al. Percutaneous coronary intervention of unprotected left main coronary artery disease as culprit lesion in patients with acute myocardial infarction. JACC Cardiovasc Interv. 2011;4:618-626.
53. Coughlan JJ, Blake N, Chongprasertpon N, et al. Revascularisation of left main stem disease:a prospective analysis of modern practice and outcomes in a non-surgical centre. Open Heart. 2018;5:e000804.
54. Cheng HY, Wang KT, Lin WH, et al. Percutaneous Coronary Intervention for Left Main Coronary Artery Disease —A Single Hospital Experience without On-Site Cardiac Surgery. Acta Cardiol Sin. 2015;31:267-279.
55. Piqueras Flores J, Sanchez Perez I, Lopez Lluva MT, Lozano F. Clinical results at a long-term follow-up of percutaneous coronary intervention in left main coronary artery disease [abstract]. Eur Heart J Suppl. 2018;7(supplement):S209.
56. Xu B, Redfors B, Yang Y, et al. Impact of Operator Experience and Volume on Outcomes After Left Main Coronary Artery Percutaneous Coronary Intervention. JACC Cardiovasc Interv. 2016;9:2086-2093.
57. Teirstein PS. Unprotected left main intervention:patient selection, operator technique, and clinical outcomes. JACC Cardiovasc Interv. 2008;1:5-13.
58. Burzotta F, Trani C. Jailed balloon protection and rescue balloon jailing techniques set the field for safer bifurcation provisional stenting. Int J Cardiol. 2015;201:376-377.
59. Tsuchikane T, Aizawa T, Tamai H, et al. Pre drug-eluting stent debulking of bifurcated coronary lesions. J Am Coll Cardiol. 2007;50:1941-1945.
60. Tanaka N, Terashima M, Kinoshita Y, et al. Unprotected left main coronary artery bifurcation stenosis:Impact of plaque debulking prior to single sirolimus-eluting stent implantation. J Invasive Cardiol. 2008;20:505-510.
61. Foin N, Sen S, Allegria E, et al. Maximal expansion capacity with current DES platforms:a critical factor for stent selection in the treatment of left main bifurcations?EuroIntervention. 2013;8:1315-1325.
62. Ng J, Foin N, Ang HY, et al. Over-expansion capacity and stent design model:An update with contemporary DES platforms. Int J Cardiol. 2016;221:171-179.
63. Rhee TM, Park KW, Lee JM, et al. Predictors and long-term clinical outcome of longitudinal stent deformation:insights from pooled analysis of Korean multicenter drug-eluting stent cohort. Circ Cardiovasc Interv. 2017;10:e005518.
64. Pandya S, Kim Y-H, Meyers S, et al. Drug-eluting versus bare-metal stents in unprotected left main stenosis. JACC Cardiovasc Interv. 2010;3:602-611.
65. Chieffo A, Morici N, Maisano F, et al. Percutaneous treatment with drug-eluting stent implantation versus bypass surgery for unprotected left main stenosis:a single-center experience. Circulation. 2006;113:2542-2547.
66. Carrie D, Lhermusier T, Hmem M, et al. Clinical and angiographic outcome of paclitaxel-eluting stent implantation for unprotected left main coronary artery bifurcation narrowing. Eurolntervention. 2006;1:396-402.
67. Burzotta F, Lassen JF, Banning AP, et al. Percutaneous coronary intervention in left main coronary artery disease:the 13th consensus document from the European Bifurcation Club. EuroIntervention. 2018;14:112-120.
68. Fajadet J, Capodanno D, Stone GW. Management of Left Main Disease:An Update. Eur Heart J. 2019;40:1454-1466.
69. De Maria GL, Banning AP. Use of Intravascular Ultrasound Imaging in Percutaneous Coronary Intervention to Treat Left Main Coronary Artery Disease. Interv Cardiol. 2017;12:8-12.
70. Chen X, Li X, Zhang JJ, et al. 3-Year Outcomes of the DKCRUSH-V Trial Comparing DK Crush With Provisional Stenting for Left Main Bifurcation Lesions. JACC Cardiovasc Interv. 2019;12:1927-1937.
71. Prati F, Romagnoli E, Gatto L, et al. Clinical Impact of Suboptimal Stenting and Residual Intrastent Plaque/Thrombus Protrusion in Patients With Acute Coronary Syndrome:The CLI-OPCI ACS Substudy (Centro per la Lotta Control L'Infarto-Optimization of Percutaneous Coronary Intervention in Acute Coronary Syndrome). Circ Cardiovasc Interv. 2016;9:e003726.
72. Kang SJ, Ahn JM, Song H, et al. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
73. Park SJ, Kim YH, Park DW, et al. Impact of intravascular ultrasound guidance on long-term mortality in stenting for unprotected left main coronary artery stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
74. Nam CW, Hur SH, Koo BK, et al. Fractional flow reserve versus angiography in left circumflex ostial intervention after left main crossover stenting. Korean Circ J. 2011;41:304-307.
75. Serruys PW, Chichareon P, Modolo R, et al. The SYNTAX score on its way out or …towards artificial intelligence:part I. EuroIntervention 2020;16:44-59.
76. Steigen TK, Maeng M, Wiseth R, et al. Randomized study on simple versus complex stenting of coronary artery bifurcation lesions:the Nordic bifurcation study. Circulation. 2006;114:1955-1961.
77. Colombo A, Bramucci E, Sacca S, et al. Randomized study of the crush technique versus provisional side-branch stenting in true coronary bifurcations:the CACTUS (Coronary Bifurcations:Application of the Crushing Technique Using Sirolimus-Eluting Stents) Study. Circulation. 2009;119:71-78.
78. Hildick-Smith D, De Belder AJ, Cooter N, et al. Randomized trial of simple versus complex drug-eluting stenting for bifurcation lesions:the British Bifurcation Coronary Study:old, new, and evolving strategies. Circulation. 2010;121:1235-1243.
79. Maeng M, Holm NR, Erglis A, et al. Long-term results after simple versus complex stenting of coronary artery bifurcation lesions:Nordic Bifurcation Study 5-year follow-up results. J Am Coll Cardiol. 2013;62:30-34.
Autor para correspondencia: Sección de Hemodinámica, Servicio de Cardiología, Hospital General Universitario de Ciudad Real, Obispo Rafael Torija s/n, 13005 Ciudad Real, España.
Correo electrónico: drlozano68@gmail.com (F. Lozano Ruiz-Poveda).