RESUMEN
Introducción y objetivos: Una proporción significativa de pacientes sometidos a implante percutáneo de válvula aórtica (TAVI) presenta indicación de anticoagulación oral por fibrilación auricular. En estos pacientes, con frecuencia el riesgo hemorrágico es alto. El objetivo del estudio fue comparar los resultados clínicos en pacientes tratados con dosis baja de apixabán o con acenocumarol, un antagonista de la vitamina K (AVK).
Métodos: Registro observacional multicéntrico que incluyó pacientes sometidos a TAVI tratados con dosis baja de apixabán (2,5 mg/12 h) o AVK, en ambos casos sin tratamiento antiplaquetario asociado. Se llevó a cabo un emparejamiento por puntuación de propensión para seleccionar dos cohortes comparables. Se recabó la información de los 12 meses posteriores al procedimiento. Se consideraron objetivos coprimarios de eficacia (muerte, infarto de miocardio e ictus) y de seguridad (hemorragias BARC ≥ 2).
Resultados: Se incluyeron 236 pacientes y se obtuvieron 2 grupos de 64 pacientes comparables en cuanto a características basales. Solo 19 (30%) cumplieron estrictamente los criterios de ajuste a la baja de la dosis de apixabán. A los 12 meses, la incidencia de muerte, infarto de miocardio e ictus fue comparable (12,5% con AVK frente a 9,3% con apixabán; p = 0,5), pero la incidencia de hemorragia BARC ≥ 2 fue significativamente mayor en el grupo de AVK (7,8 frente a 0%; p = 0,02). La mayoría de los eventos trombóticos en el grupo de apixabán se observaron en pacientes con reducción de dosis no ajustada a criterios.
Conclusiones: En este registro de pacientes con TAVI y fibrilación auricular, el uso de la dosis baja de apixabán en comparación con el uso de AVK, sin antiagregantes concomitantes, se asoció a una menor incidencia de hemorragias mayores con una incidencia similar de eventos tromboembólicos.
Palabras clave: TAVI. Anticoagulación. Apixabán. Antagonistas vitamina K.
Abstract
Introduction and objectives: A significant amount of patients undergoing transcatheter aortic valve implantation (TAVI) have an indication for oral anticoagulation due to atrial fibrillation. In these patients the bleeding risk is often high. The purpose of this study was to compare the clinical outcomes of patients treated with low doses of apixaban or the vitamin K antagonist (VKA) acenocumarol in this setting.
Methods: Multicenter observational registry including patients treated after TAVI with low doses of apixaban (2.5 mg/12 hours) or VKA both without associated antiplatelet therapy. Propensity score matching was conducted to select 2 comparable cohorts. Data were gathered for 12 months following the procedure. Coprimary endpoints of efficacy (death, myocardial infarction, and stroke) and safety (bleeding BARC ≥ 2) were considered.
Results: A total of 236 patients were included. They were divided into 2 comparable groups of 64 patients each. Only 19 patients (30%) strictly met the dose adjustment criteria for apixaban. The rate of death, myocardial infarction, and stroke was similar at the 12-month follow-up (12.5% with VKA vs 9.3% with apixaban, P = .5), but the rate of bleeding BARC ≥ 2 was significantly higher in the VKA group (7.8% vs 0%; P = .02). Most of the events seen in the apixaban group occurred in patients with incorrect dose titration.
Conclusions: In this registry of patients treated with TAVI and atrial fibrillation the use of low-dose apixaban compared to VKA—both without antiplatelet agents—was associated to a lower rate of actionable bleeding and a similar rate of thrombotic events.
Keywords: TAVI. Anticoagulation. Apixaban. Vitamin K antagonist.
Abreviaturas ACOD: anticoagulantes orales de acción directa. AVK: antagonista de la vitamina K. BARC: Bleeding Academic Research Consortium. MACE: eventos cardiovasculares adversos mayores. FA: fibrilación auricular. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El crecimiento exponencial del número de procedimientos de implante percutáneo de válvula aórtica (TAVI) en los últimos años es consecuencia de la extensa y sólida evidencia científica que ha ampliado sus indicaciones1-3.
La fibrilación auricular (FA) es un hallazgo frecuente en estos pacientes4. Su presencia previa al implante, así como su nueva aparición durante el seguimiento, se asocian a una mayor mortalidad y a una más alta incidencia de ictus5, pero también a más hemorragias debidas en gran medida a la necesidad de anticoagulación6,7. El riesgo de hemorragia es en particular elevado en los pacientes sometidos a TAVI dado su perfil de edad generalmente avanzada.
Los anticoagulantes orales de acción directa (ACOD) han mostrado un mejor perfil de seguridad y eficacia que los antagonistas de la vitamina K (AVK) en el contexto de la FA no valvular. Sin embargo, existen pocos estudios que analicen su papel en pacientes con FA valvular y en la actualidad solo las guías de valvulopatías de la European Society of Cardiology de 2017 los recomiendan como clase IIa C, pero a partir del tercer mes del implante de una bioprótesis quirúrgica8. No obstante, hasta la fecha el dabigatrán es el único ACOD que ha demostrado ser no inferior a los AVK en pacientes con bioprótesis quirúrgicas9.
Respecto a los pacientes con FA sometidos a TAVI, existe muy poca evidencia para los ACOD. En uno de los escasos estudios publicados, el uso de apixabán se asoció a una significativa menor incidencia de eventos adversos a los 30 días que el uso de AVK10. No obstante, existían diferencias significativas entre grupos, no se realizó emparejamiento estadístico alguno y se incluyeron pacientes con antiagregación asociada.
La población tratada actualmente con TAVI se caracteriza por tener una edad avanzada (con frecuencia sobre los 80 años), grados variables de insuficiencia renal crónica y en ocasiones peso corporal bajo. Estas condiciones podrían justificar una relativamente alta prevalencia de uso de la dosis reducida de apixabán (2,5 mg/12 h).
En el presente estudio nos planteamos evaluar el uso de apixabán a dosis baja en pacientes con TAVI y comparar su evolución clínica a largo plazo con la de pacientes tratados con AVK. Para ello se diseñó un registro multicéntrico que incluye pacientes con indicación de anticoagulación oral (sin antiagregación asociada) tras TAVI a base de AVK o de apixabán a dosis de 2,5 mg/12 h, entre los que se efectuó un emparejamiento por índice de propensión de tratamiento.
MÉTODOS
Población del estudio
Se diseñó un registro observacional multicéntrico de carácter retrospectivo, a partir de la revisión de los registros de TAVI individuales de 4 centros hospitalarios del ámbito nacional.
La población a estudio estuvo formada por todos los pacientes consecutivos sometidos a TAVI desde 2008 con diagnóstico de FA al alta del procedimiento y con indicación de anticoagulación oral crónica aislada, ya fuera con AVK o con apixabán a dosis de 2,5 mg/12 h, y que contaran con al menos 1 año de seguimiento. Se excluyeron, por tanto, los pacientes fallecidos durante el ingreso, sin contemplar ningún criterio adicional de exclusión.
La elección de la dosis de apixabán estuvo siempre sujeta a criterio del médico responsable del paciente. En relación a este aspecto, la Agencia Europea de Medicamentos recomienda la dosis reducida de apixabán en pacientes con FA no valvular y filtrado glomerular de 15-29 ml/min y en aquellos con al menos 2 de las siguientes características: edad ≥ 80 años, peso corporal ≤ 60 kg o creatinina sérica ≥ 1,5 mg/dl (133 µmol/l)11.
Objetivos del estudio y definiciones de eventos
En cada caso registrado se recogieron todas las variables clínicas, datos demográficos y factores de riesgo cardiovascular. Además, en todos los pacientes se tuvieron en cuenta los antecedentes previos al TAVI, como presencia de enfermedad cardiovascular o cirugías cardiacas anteriores, enfermedad pulmonar o renal crónica, cirrosis hepática o neoplasias. También se incluyeron las variables asociadas con su estado cardiovascular, como función ventricular, estenosis aórtica y enfermedad coronaria. Los riesgos quirúrgicos se evaluaron mediante las escalas de riesgo EuroSCORE log, EuroSCORE II y Society of Thoracic Surgery (STS) score. Dada la presencia de FA al alta (ya conocida o de novo), se calcularon los riesgos anuales de eventos tromboembólicos usando la escala CHA2DS2-VASc y el riesgo hemorrágico con el HAS-BLED en todos los pacientes.
Se recogieron datos relacionados con el procedimiento, así como las complicaciones derivadas de este definidas por los criterios actualizados del Valve Academic Research Consortium-2 (VARC-2)12.
Se analizó la incidencia de eventos cardiovasculares adversos mayores (MACE) en todos los pacientes a 1 año de seguimiento tras el procedimiento de implante de TAVI en cada centro. Se consideraron MACE la muerte por cualquier causa, el ictus (isquémico o hemorrágico) y el infarto agudo de miocardio, todos ellos definidos también por los criterios VARC-211. Además, se analizó la incidencia de hemorragia, categorizada según la clasificación Bleeding Academic Research Consortium (BARC)12 y considerada relevante si BARC ≥ 2. Se consideró un objetivo combinado neto de eficacia-seguridad que incluía todos los MACE y la hemorragia BARC ≥ 2.
Se consideraron 2 objetivos coprimarios: uno de eficacia (compuesto por los MACE) y otro de seguridad (las hemorragias BARC ≥ 2). Los objetivos secundarios fueron un objetivo combinado neto de eficacia-seguridad, muerte total, muerte de causa cardiaca, infarto de miocardio, ictus e ictus hemorrágico.
La adjudicación de eventos quedó a criterio de los investigadores de cada centro, provistas las definiciones previamente indicadas. La base de datos no incluyó ninguno que permitiera la identificación de los pacientes, garantizando la total anonimidad. Se contó con la aprobación del comité de ética para investigación del centro coordinador.
Análisis estadístico
Las variables continuas se expresaron mediante media y desviación estándar o mediana y rango intercuartílico, según el tipo de distribución. Las categóricas se expresaron como porcentajes. Mediante la prueba de Kolmogorov-Smirnov se determinó si la distribución de las variables continuas era normal, en cuyo caso se realizó la comparación de ambos grupos mediante la prueba t de Student para datos independientes, y si seguía una distribución no normal se utilizó la prueba de Wilcoxon. Para las comparaciones de variables cualitativas o categóricas se utilizó la prueba de χ2 o la prueba exacta de Fisher si era preciso. Se hizo un análisis de riesgos proporcionales de Cox en la muestra total antes del emparejamiento para identificar variables predictoras del evento combinado neto. Se incluyeron las variables que mostraban una p < 0,1 en el análisis univariado.
Dadas las limitaciones y los sesgos en la interpretación de las posibles asociaciones en la comparación de variables no ajustadas al tratarse de un estudio observacional, se realizó un ajuste por índice de propensión utilizando el modelo de regresión logística. Se estableció el tipo de anticoagulación al alta (apixabán 2,5 mg frente a AVK) como variable dependiente y se incluyeron en el análisis como variables independientes las características basales que se detallan en la tabla 1. Puesto que el número de pacientes fue claramente menor en el grupo de apixabán, el emparejamiento por índice de propensión de tratamiento tuvo como objetivo emparejar cada paciente del grupo de apixabán con un paciente del grupo de AVK. Este procedimiento incluyó 2 etapas: 1) Las puntuaciones de propensión se estimaron mediante regresión logística, en la que se utilizó el tratamiento con apixabán como variable de resultado y todas las covariables analizadas como predictores; y 2) los pacientes fueron emparejados 1:1 usando una simple coincidencia del caso «vecino» más cercano que se basa en un algoritmo de correspondencia que clasifica las observaciones en el grupo de apixabán por su puntuación de propensión estimada. Luego se combina cada unidad secuencialmente con una unidad del grupo AVK que tenga la puntuación de propensión más cercana. Todas las diferencias de medias estandarizadas después del emparejamiento fueron inferiores al 10%. La calibración se valoró usando la prueba de Hosmer-Lemeshow y la precisión se evaluó usando el área bajo la curva ROC (Receiver Operating Characteristic). Se utilizó el programa PS Matching junto con SPSS versión 22.0 (IBM, Estados Unidos). El programa PS Matching realiza todos los análisis en R a través del SPSS R-Plugin. Se analizó la supervivencia libre de eventos mediante el método de Kaplan-Meier, utilizando el log-rank test para la comparación de ambos grupos. Todos los análisis fueron bilaterales y se consideraron valores estadísticamente significativos aquellos con p < 0,05. Los análisis estadísticos se realizaron con el programa estadístico SPSS 22.0.
Tabla 1. Características basales antes y después del ajuste por índice de propensión
| Cohorte global | Cohorte emparejada | |||||
|---|---|---|---|---|---|---|
| Apixabán (n = 64) | AVK (n = 172) | p | Apixabán (n = 64) | AVK (n = 64) | p | |
| Sexo masculino | 41 (64) | 60 (35) | < 0,001 | 41 (64) | 38 (59) | 0,6 |
| Edad (años) | 82 ± 6 | 83 ± 6 | 0,3 | 82 ± 6 | 81 ± 7,5 | 0,7 |
| Peso (kg) | 72 ± 12 | 71 ± 17 | 0,6 | 72 ± 12 | 74 ± 14 | 0,5 |
| Talla (cm) | 161 ± 10 | 158 ± 14 | 0,1 | 161 ± 10 | 160 ± 9 | 0,32 |
| HTA | 55 (86) | 140 (81) | 0,4 | 55 (86) | 48 (75) | 0,11 |
| Diabetes mellitus | 27 (42) | 51 (30) | 0,07 | 27 (42) | 19 (30) | 0,14 |
| Filtrado glomerular basal (ml/min) | 58 ± 20 | 61 ± 23 | 0,3 | 58 ± 20 | 60 ± 25 | 0,6 |
| SCA previo | 4 (6) | 10 (6) | 0,9 | 4 (6) | 4 (6) | 1 |
| ACTP previa | 9 (14) | 10 (6) | 0,04 | 9 (14) | 8 (13) | 0,8 |
| PAoC previo | 3 (5) | 12 (7) | 0,52 | 3 (5) | 4 (6) | 0,7 |
| RVAo previo | 7 (11) | 6 (4) | 0,03 | 7 (11) | 4 (6) | 0,3 |
| Ictus previo | 3 (5) | 26 (15) | 0,03 | 3 (5) | 3 (5) | 1 |
| EPOC | 19 (30) | 39 (23) | 0,27 | 19 (30) | 15 (23) | 0,4 |
| Cirrosis | 0 | 4 (2) | 0,6 | 0 | 1 (1,6) | 1 |
| Neoplasia | 11 (17) | 16 (9) | 0,09 | 11 (17) | 6 (9) | 0,2 |
| Enfermedad vascular periférica | 7 (11) | 4 (5) | 0,15 | 7 (11) | 2 (6) | 0,4 |
| NYHA III-IV | 30 (51) | 111 (65) | 0,06 | 30 (51) | 37 (58) | 0,4 |
| FEVI basal (%) | 53 ± 12 | 56 ± 13 | 0,1 | 53 ± 12 | 56 ± 12 | 0,3 |
| EuroSCORE log | 13,3 ± 9 | 18,5 ± 13 | 0,002 | 13,3 ± 9 | 14 ± 8 | 0,7 |
| EuroSCORE II | 4,2 ± 5 | 6,4 ± 6 | 0,013 | 4,2 ± 5 | 4,7 ± 4 | 0,55 |
| STS mortalidad | 6 [2-10] | 7 [5-15] | 0,4 | 6 [2-10] | 11 [3-11] | 0,5 |
| CHA2DS2-VASc | 4,5 ± 1,1 | 4,6 ± 1,4 | 0,55 | 4,5 ± 1,1 | 4 ± 1,3 | 0,07 |
| HAS-BLED | 2,8 ± 1 | 2,74 ± 1 | 0,8 | 2,8 ± 1 | 2,5 ± 1,1 | 0,3 |
ACTP: angioplastia coronaria transluminal percutánea; AVK: antagonistas de la vitamina K; HTA: hipertensión arterial; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association; PAoC: pontaje aortocoronario previo; RVAo: recambio valvular aórtico; SCA: síndrome coronario agudo; STS: Surgeon Thoracic Score. Los datos se muestran como n (%), media ± (desviación estándar) o mediana [rango intercuartílico]. | ||||||
RESULTADOS
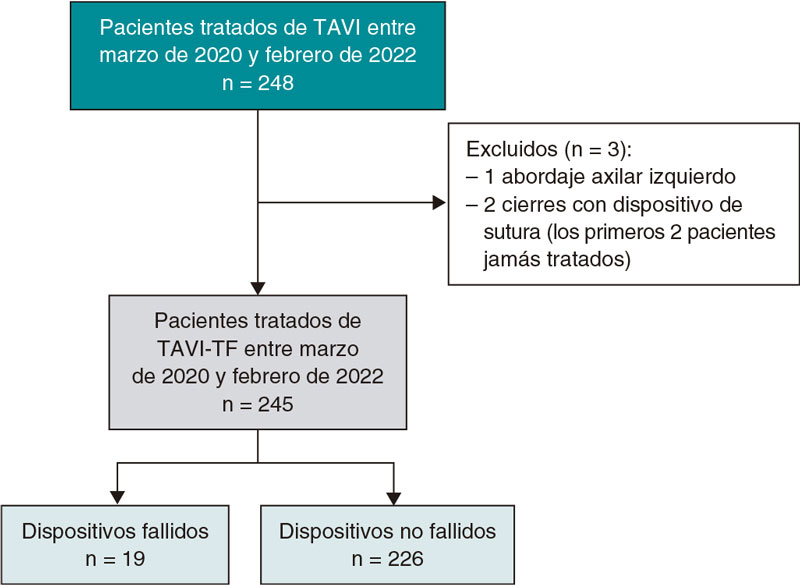
De un total de 1.791 pacientes se obtuvo una cohorte final de 236 que cumplían criterios de inclusión, de los cuales 64 (27%) fueron tratados con dosis reducida de apixabán al alta tras el TAVI y 172 (73%) fueron tratados con AVK. Mediante emparejamiento por índice de propensión de tratamiento se obtuvieron 2 grupos de 64 pacientes cada uno. El diagrama de flujo de los pacientes se muestra en la figura 1. La distribución de casos con apixabán por centros fue del 60, el 20, el 14 y el 3%.
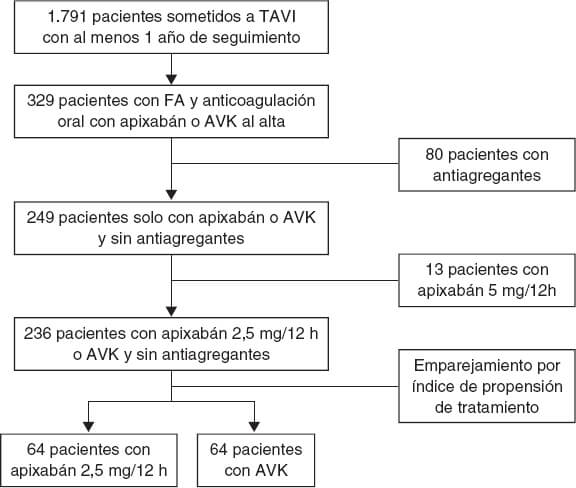
Figura 1. Diagrama de flujo del estudio. AVK: antagonistas de la vitamina K; FA: fibrilación auricular; TAVI: implante percutáneo de válvula aórtica.
En cuanto a la adecuación de la dosificación a la baja de apixabán respecto al grado de cumplimiento de las características recomendadas por la Agencia Europea de Medicamentos11, se observó que solo 19 (30%) pacientes cumplían estrictamente los requisitos (figura 2). Un 68% de los pacientes ≥ 80 años presentaban un grado de enfermedad renal crónica IIIA (filtrado glomerular de 30-59 ml/min), habiéndose considerado ese factor como suficiente para indicar la dosis de 2,5 mg.
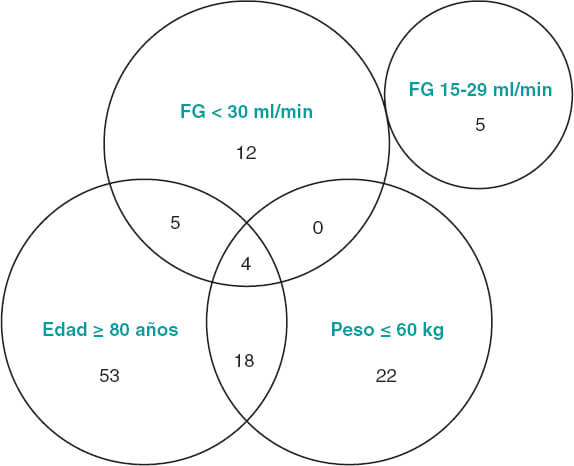
Figura 2. Agrupación de los pacientes tratados con apixabán a dosis reducida según las variables contempladas para la reducción de dosis. Se muestra el número de pacientes que cumplía cada una de las condiciones, así como las posibles combinaciones de estas. La Agencia Europea de Medicamentos recomienda la dosis reducida de apixabán en pacientes con fibrilación auricular no valvular y filtrado glomerular (FG) de 15-29 ml/min, y en aquellos con al menos 2 de las siguientes características: edad ≥ 80 años, peso corporal ≤ 60 kg o creatinina sérica ≥ 1,5 mg/dl (133 µmol/l)11.
En la tabla 1 se muestran las características basales de la cohorte global y las de la cohorte ajustada por índice de propensión. En la cohorte global se observó que el grupo de apixabán incluía más varones, más pacientes con antecedentes de intervención coronaria y valvular, y menos con historia de ictus. Los valores de los índices EuroSCORE eran más bajos que en el grupo de AVK, pero los índices de riesgo hemorrágico eran similares. No se observaron diferencias significativas entre los grupos emparejados.
Las características de los procedimientos y las complicaciones observadas en los grupos ya emparejados se muestran en la tabla 2. No se hallaron diferencias significativas para ninguno de los aspectos analizados. Es interesante señalar que los pacientes del grupo de apixabán tuvieron cifras más altas de hemoglobina al alta. En este grupo, además, 10 pacientes habían llegado al TAVI bajo tratamiento con anticoagulación y terapia antiagregante (suspendida tras el TAVI), frente a solo 1 paciente en el grupo con AVK. En cuanto a la cronología de la FA, todos los pacientes del grupo de AVK ya tenían FA antes del TAVI, mientras que en el grupo de apixabán 5 pacientes la desarrollaron tras el procedimiento de TAVI.
Tabla 2. Características del procedimiento, complicaciones y características al alta de la cohorte emparejada
| Apixabán (n = 64) | AVK (n = 64) | p | |
|---|---|---|---|
| Prótesis aórtica expandible con balón | 51 (80) | 50 (78) | 0,8 |
| Acceso femoral | 64 (100) | 62 (97) | 0,5 |
| Éxito del implante | 64 (100) | 64 (100) | 1 |
| Transfusiones | 7 (11) | 5 (8) | 0,5 |
| Oclusión coronaria | 0 | 0 | |
| Embolización de la prótesis | 0 | 0 | |
| Rotura anillo | 0 | 0 | |
| Ictus periprocedimiento | 1 (1,6) | 1 (1,6) | 1 |
| Complicación vascular | 7 (11) | 10 (16) | 0,4 |
| Hemorragia BARC ≥ 2 | 4 (6,3) | 4 (6,3) | 1 |
| SCA periprocedimiento | 0 | 0 | |
| Necesidad de marcapasos | 8 (13) | 10 (16) | 0,6 |
| Fibrilación auricular de novo | 5 (8) | 0 | 0,06 |
| Hemoglobina (g/dl) al alta | 12 ± 1,6 | 11 ± 1,4 | 0,05 |
| Plaquetas al alta (109/l) | 133 ± 92 | 160 ± 60 | 0,2 |
| Filtrado glomerular (ml/min) al alta | 68 [53-82] | 66 [40-82] | 0,5 |
AVK: antagonistas de la vitamina K; BARC: Bleeding Academic Research Consortium; SCA: síndrome coronario agudo. Los datos se muestran como n (%), media ± desviación estándar o mediana [rango intercuartílico]. | |||
No se perdieron pacientes en el seguimiento clínico. En la tabla 3 se recogen los eventos cardiovasculares observados desde el alta y hasta 1 año de seguimiento, sin ponerse de manifiesto diferencias significativas entre ambos grupos para los MACE. En el grupo tratado con AVK se produjeron 4 (6%) muertes, de las cuales 2 tuvieron causa cardiaca (insuficiencia cardiaca y muerte súbita) y otras 2 fueron secundarias a hemorragias mayores (ictus hemorrágico y shock hipovolémico tras una caída con fractura de cadera). Los 3 pacientes fallecidos en el grupo de apixabán lo fueron por patología pulmonar. Es interesante observar los eventos dentro del grupo de apixabán según el uso de dosis reducida ajustada o no a criterios, ya que los MACE se concentraron en el grupo con dosis no ajustada.
Tabla 3. Eventos cardiovasculares adversos mayores y hemorragias a 12 meses
| Apixabán | AVK (n = 64) | p* | ||||
|---|---|---|---|---|---|---|
| DR (n = 64) | DRA (n = 19) | DRNA (n = 45) | ||||
| MACE | 6 (9,3) | 1 (5,3) | 5 (11) | 8 (12,5) | 0,5 | |
| Muerte | 3 (4,7) | 0 | 3 (4,7) | 4 (6,2) | 0,7 | |
| Muerte de causa cardiaca | 0 | 0 | 0 | 2 (3,1) | 0,3 | |
| Infarto de miocardio | 1 (1,6) | 0 | 1 (2,2) | 1 (1,6) | 1 | |
| Ictus | 2 (3,1) | 1 (5,3) | 1 (2,2) | 3 (4,7) | 0,9 | |
| Ictus hemorrágico | 0 | 0 | 0 | 2 (3,1) | 0,5 | |
| Hemorragias BARC ≥ 2 | 0 | 0 | 0 | 5 (7,8) | 0,02 | |
| Objetivo seguridad-eficacia** | 4 (6,2) | 0 | 4 (8,8) | 8 (12,5) | 0,23 | |
AVK: antagonistas de la vitamina K; DR: dosis reducida; DRA: dosis reducida ajustada; DRNA: dosis reducida no ajustada; MACE: eventos cardiovasculares adversos mayores. Los datos se muestran como n (%). * Valores de p para la comparación de apixabán DR frente a AVK. ** Combinado de muerte, infarto de miocardio, ictus y hemorragias BARC ≥ 2. | ||||||
Solo se comunicaron hemorragias relevantes (BARC ≥ 2) en el grupo de AVK, con una diferencia significativa respecto al grupo de apixabán. Estos eventos ocurrieron en los meses 1, 3, 5, 6 y 11 tras el TAVI. De esas hemorragias mayores, 3 se debieron a causas digestivas, una fue por una hemorragia subaracnoidea y otra fue un hematoma espontáneo en los rectos anteriores del abdomen. Todos estos pacientes requirieron ingreso, 1 intervención quirúrgica y 4 recibieron transfusiones hemáticas. En el grupo de apixabán, la tasa de hemorragias BARC ≥ 2 observada (0%) fue inferior a la esperada por el índice HAS-BLED (3,4%), mientras que en el grupo de AVK fue a la inversa: la tasa observada (7,8%) fue superior a la esperada (2,8%).
Las curvas de supervivencia acumulada libre de MACE al año no mostraron diferencias significativas entre ambos grupos, tal como puede verse en la figura 3. En la figura 4 se muestran las curvas de supervivencia libre de hemorragias BARC ≥ 2, con diferencias significativas favorables al grupo de apixabán. Las curvas de supervivencia libre de muerte, infarto, ictus y hemorragias BARC ≥ 2 no mostraron diferencias significativas, pero sí una tendencia favorable al apixabán (figura 5). El análisis multivariado de Cox realizado sobre la muestra total, previamente al emparejamiento de casos, identificó el uso de apixabán como predictor independiente para el objetivo combinado neto de eficacia y seguridad (hazard ratio = 0,56; intervalo de confianza del 95%, 0,23-0,98; p = 0,04).
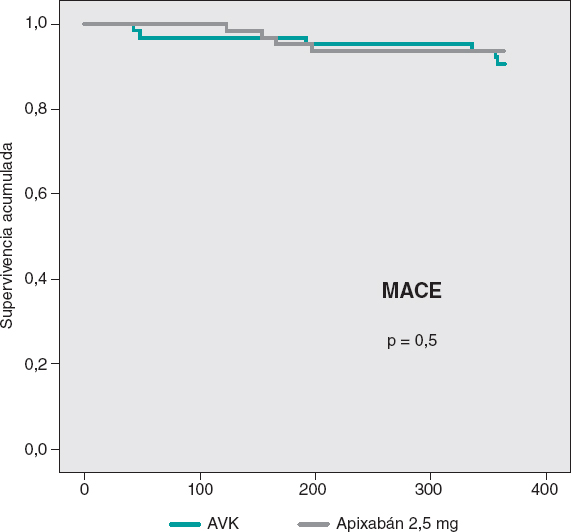
Figura 3. Curvas de Kaplan-Meier de supervivencia libre de eventos cardiovasculares adversos mayores (MACE) a 1 año. AVK: antagonista de la vitamina K.
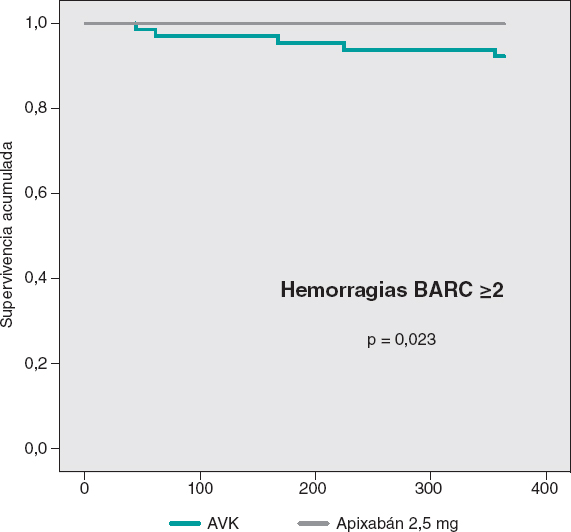
Figura 4. Curvas de Kaplan-Meier de supervivencia libre de hemorragias BARC ≥ 2. AVK: antagonista de la vitamina K.
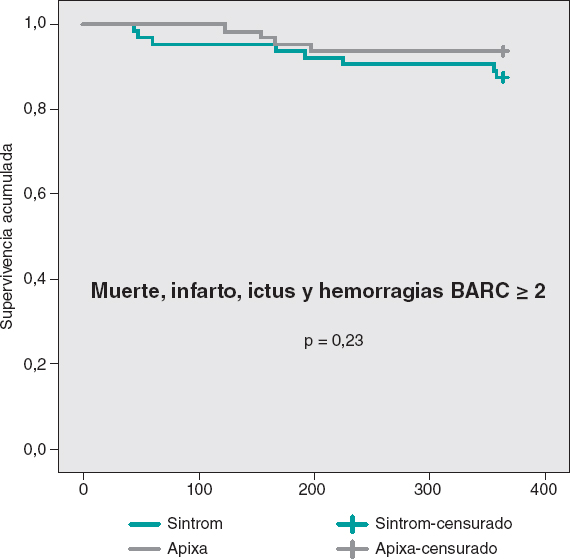
Figura 5. Curvas de Kaplan-Meier de supervivencia libre de muerte, infarto, ictus y hemorragias BARC ≥ 2.
DISCUSIÓN
Los hallazgos principales de este estudio son: a) el uso de apixabán es todavía minoritario respecto al de AVK en la población con TAVI y FA; b) el uso de apixabán en dosis baja es muy frecuente en este contexto, pero en muchas ocasiones no se ajusta de manera estricta a las instrucciones de uso contempladas y es habitual la infradosificación; c) el tratamiento con apixabán en dosis reducida, en comparación con el de AVK, se asoció a incidencias muy similares de eventos trombótico-isquémicos y a un significativo menor riesgo de hemorragia mayor.
Estos hallazgos, con las reservas derivadas de las limitaciones del estudio, estarían en consonancia con los resultados del subanálisis del estudio ARISTOTLE13 en pacientes con bioprótesis, que muestran la seguridad y la eficacia del apixabán en pacientes valvulares, aunque entre estos últimos solo el 31% superaban los 75 años de edad. Un subestudio del ensayo ENGAGE AF-TIMI 4814 con 191 pacientes con implantación previa de una bioprótesis quirúrgica o transcatéter y FA mostró una reducción significativa de las hemorragias mayores con dosis bajas (30 mg) de edoxabán en comparación con warfarina. Las dosis bajas y altas (60 mg) de edoxabán se asociaron con una reducción en el compuesto de accidente cerebrovascular, embolia sistémica, hemorragia grave o muerte.
La población sometida a TAVI abarca un colectivo de edad muy avanzada y con múltiple comorbilidad, muy poco representado en los estudios clínicos de otros contextos como el de la FA no valvular. La presencia de FA previa o desarrollada de novo tras el TAVI no es infrecuente en esta población y suma un riesgo tanto embólico como hemorrágico superior al de otras poblaciones, lo que supone un reto importante al decidir el mejor tratamiento antitrombótico.
Existen aún pocos estudios que hayan comparado los ACOD con los AVK en el contexto de TAVI, y son registros. En el antes citado de Seeger et al.10 se compararon 141 pacientes tratados con apixabán (la mayoría con dosis 5 mg) y 131 con AVK, y se encontró un mejor perfil de seguridad y una similar eficacia con apixabán. No obstante, en este registro, además de no evaluar la dosis reducida de apixabán, no se hizo emparejamiento estadístico y se incluyeron casos con tratamiento antiplaquetario concomitante. En nuestro estudio creímos muy conveniente excluir a los pacientes con terapia antiagregante asociada y efectuar un emparejamiento por índice de propensión de tratamiento, ya que ambos aspectos reducen de forma notable la carga de sesgos inherente a todo análisis comparativo derivado de registros. Por otra parte, el estudio de la dosis reducida resultaba muy pertinente dado su frecuente uso en esta población.
En otro estudio se comparó la evolución clínica de 154 pacientes tratados con varios ACOD y 172 tratados con AVK, siempre sin antiplaquetarios15, pero de nuevo sin emparejamiento estadístico y observando significativas diferencias entre grupos. Los autores encontraron unos perfiles de eficacia y seguridad muy similares, aunque el grupo de ACOD mostraba un perfil basal de riesgo hemorrágico y trombótico más adverso.
Finalmente, en los registros RESOLVE (The Assessment of Transcatheter and Surgical Aortic Bioprosthetic Valve Thrombosis and Its Treatment With Anticoagulation) y SAVORY (Subclinical Aortic Valve Bioprosthesis Thrombosis Assessed With Four- Dimensional Computed Tomography) no se encontraron diferencias significativas en cuanto a reducción del movimiento de los velos de la prótesis entre los ACOD y la warfarina (3 frente a 4%, respectivamente; p = 0,72), aunque ambos parecían mejores que la no anticoagulación16.
Merece discusión la alta prevalencia de infradosificación del apixabán en esta población. Creemos que esta puede venir condicionada por la percepción de un muy alto riesgo hemorrágico en estos pacientes, muchos de ellos octogenarios y con alta prevalencia de enfermedad renal crónica así como de otras enfermedades, y un variable grado de fragilidad, que si bien no es un criterio establecido para modular el tipo y la dosis de anticoagulación, sí puede influir en la decisión.
El hecho de haber encontrado en este registro diferencias favorables al apixabán con dosis de 2,5 mg respecto a los AVK podría hacer pensar que la infradosificación no penaliza tanto como en el contexto general de los pacientes con FA no valvular13, y es más, se asocia a un mejor perfil de seguridad sin detrimento de la eficacia. Sin embargo, no puede recomendarse de forma abierta el uso de la dosis reducida y creemos en el rigor del ajuste de dosis. Aunque el tamaño de los subgrupos según ajuste de dosis correcto o no era pequeño y no permite extraer resultados concluyentes, dentro del grupo de apixabán se observaron más eventos trombóticos-isquémicos en el grupo de ajuste incorrecto. Ahora bien, es preciso tener en cuenta que la dosificación debe ser dinámica, ya que las condiciones de ajuste de dosis varían a lo largo del seguimiento, y así se optimiza en todo momento el tratamiento de estos pacientes.
Dicho lo anterior, las indicaciones de tratamiento con estos fármacos están sufriendo modificaciones a raíz de los datos recientes de la vida real. Hasta hace 1 año, el apixabán estaba contraindicado en pacientes con deterioro renal grave, en los que el tratamiento con AVK seguía siendo de elección. Los estudios más recientes demuestran el claro beneficio en términos de hemorragias con la dosis de apixabán de 2,5 mg, y en términos de eventos tromboembólicos y mortalidad con la de 5 mg, en pacientes con enfermedad renal grave y diálisis17.
Lo complejo del tema queda ilustrado por los resultados del ensayo GALILEO18 (Global Study Comparing a rivAroxaban-based Antithrombotic Strategy to an antipLatelet-based Strategy After Transcatheter aortIc vaLve rEplacement to Optimize Clinical Outcomes). Este estudio ha evidenciado que, en pacientes sin indicación de anticoagulación oral después de TAVI, una estrategia de tratamiento que incluye rivaroxabán a dosis de 10 mg al día más un antiagregante en los primeros 90 días se asoció con un mayor riesgo de muerte o de complicaciones tromboembólicas y un mayor riesgo de hemorragia que una estrategia basada en terapia antiplaquetaria dual por 90 días y luego simple.
Los estudios aleatorizados actualmente en marcha aportarán evidencias más sólidas sobre las mejores estrategias antitrombóticas en los pacientes tras TAVI con y sin FA19.
Limitaciones
La principal limitación del estudio es el no ser aleatorizado. Como todo registro observacional, está sujeto a factores confusores más o menos evidentes. Aunque el uso del emparejamiento por índice de propensión de tratamiento derivó en 2 grupos de características basales muy similares, la probabilidad de sesgos no queda eliminada.
El tamaño muestral es la segunda limitación más importante. El volumen de pacientes con TAVI y a su vez con indicación de anticoagulación oral aislada no es alto en un centro aislado de nuestro medio, y más aún si se quiere incluir los tratados específicamente con apixabán a dosis reducida. Por ello, se diseñó un estudio multicéntrico con centros de alto volumen (en comparación con la media del país), pero aun así el tamaño de muestra no pudo ser mayor. Esto hace que el estudio esté infrapotenciado y tenga que considerarse exploratorio y generador de hipótesis. Esta limitación resulta todavía más evidente para la comparación de los subgrupos según el tipo de ajuste de dosis. No obstante, en espera de ensayos debidamente potenciados, los resultados de registros de este tipo contribuyen a aportar algo de conocimiento.
La adjudicación de eventos no se efectuó de manera centralizada, aunque se ajustaron a las definiciones estandarizadas previamente establecidas11.
CONCLUSIONES
El uso de dosis baja de apixabán (2,5 mg/12 h) en pacientes sometidos a TAVI no se adecuó con frecuencia de forma estricta a las recomendaciones oficiales. En este registro, el uso de apixabán a dosis reducida, en comparación con el uso de acenocumarol, se asoció con cifras muy similares de eventos trombóticos-isquémicos, pero con un significativo menor riesgo de hemorragia mayor. Este estudio sugiere que, en los pacientes tratados con TAVI que tienen FA, el empleo de apixabán a dosis reducida (en caso de estar apropiadamente indicada) resultaría más seguro e igual de eficaz que el de acenocumarol.
CONFLICTO DE INTERESES
J.M. de la Torre Hernández ha recibido ayuda a la investigación no condicionada y panel de asesoría (Bristol-Myers Squibb). Asimismo, es Editor Jefe de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
¿Qué se sabe del tema?
- La realización de TAVI está experimentando un notable crecimiento. La prevalencia de FA entre los pacientes con TAVI es alta. Los ACOD han mostrado un mejor perfil de seguridad y eficacia que los AVK en el contexto de la FA no valvular, pero existen pocos estudios que analicen su papel en pacientes con TAVI y FA, y en concreto ninguno que evalué el de la dosis reducida de apixabán.
¿Qué aporta de nuevo?
- Este registro multicéntrico muestra que el uso de apixabán es todavía minoritario respecto al de AVK en la población con TAVI y FA. Entre los pacientes tratados con apixabán, el empleo de dosis baja es muy frecuente, pero en muchas ocasiones no se ajusta de manera estricta a las instrucciones de uso contempladas. En este estudio, el tratamiento con apixabán a dosis reducida, en comparación con el de AVK, se asoció a incidencias muy similares de eventos trombóticos-isquémicos y a un significativo menor riesgo de hemorragia relevante.
BIBLIOGRAFÍA
1. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
2. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2016;374:1609-1620.
3. Waksman R, Rogers T, Torguson R, et al. Transcatheter Aortic Valve Replacement in Low-Risk Patients With Symptomatic Severe Aortic Stenosis. J Am Coll Cardiol. 2018;72:2095-2105.
4. Koniari I, Tsigkas G, Kounis N, et al. Incidence, pathophysiology, predictive factors and prognostic implications of new onset atrial fibrillation following transcatheter aortic valve implantation. J Geriatr Cardiol. 2018;15:50-54.
5. Biviano AB, Nazif T, Dizon J, et al. Atrial Fibrillation Is Associated With Increased Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement:Insights From the Placement of Aortic Transcatheter Valve (PARTNER) Trial. Circ Cardiovasc Interv. 2016 ;9:e002766.
6. Kapadia S, Agarwal S, Miller DC, et al. Insights Into Timing, Risk Factors, and Outcomes of Stroke and Transient Ischemic Attack After Transcatheter Aortic Valve Replacement in the PARTNER Trial (Placement of Aortic Transcatheter Valves). Circ Cardiovasc Interv. 2016;9. pii:e002981.
7. Tarantini G, Mojoli M, Urena M, Vahanian A. Atrial fibrillation in patients undergoing transcatheter aortic valve implantation:epidemiology, timing, predictors, and outcome. Eur Heart J. 2017;38:1285-1293.
8. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
9. Durães AR, de Souza Roriz P, de Almeida Nunes B, et al. Dabigatran Versus Warfarin After Bioprosthesis Valve Replacement for the Management of Atrial Fibrillation Postoperatively:DAWA Pilot Study. Drugs R D. 2016;16:149-154.
10. Seeger J, Gonska B, Rodewald C, et al. Apixaban in Patients With Atrial Fibrillation After Transfemoral Aortic Valve Replacement. JACC Cardiovasc Interv. 2017;10:66-74.
11. Agencia Europea de Medicamentos. Anexo I. Ficha técnica o resumen de las características del producto. Disponible en:https://www.ema.europa.eu/en/documents/product-information/eliquis-epar-product-information_es.pdf. Consultado 12 Mar 2020.
12. Kappetein AP, Head SJ, Généreux P, et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. J Thorac Cardiovasc Surg. 2013;145:6-23.
13. Guimarães PO, Pokorney SD, Lopes RD, et al. Efficacy and safety of apixaban vs warfarin in patients with atrial fibrillation and prior bioprosthetic valve replacement or valve repair:Insights from the ARISTOTLE trial. Clin Cardiol. 2019;42:568-571.
14. Carnicelli AP, De Caterina R, Halperin JL, et al. ENGAGE AF-TIMI 48. Edoxaban for the Prevention of Thromboembolism in Patients With Atrial Fibrillation and Bioprosthetic Valves. Circulation. 2017;135:1273-1275.
15. Geis NA, Kiriakou C, Chorianopoulos E, Uhlmann L, Katus HA, Bekeredjian R. NOAC monotherapy in patients with concomitant indications for oral anticoagulation undergoing transcatheter aortic valve implantation. Clin Res Cardiol. 2018;107:799-806.
16. Chakravarty T, Søndergaard L, Friedman J, et al. RESOLVE and SAVORY Investigators. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves:an observational study. Lancet. 2017;389:2383-2392.
17. Siontis KC, Zhang X, Eckard A, et al. Outcomes Associated With Apixaban Use in Patients With End-Stage Kidney Disease and Atrial Fibrillation in the United States. Circulation. 2018;138:1519-1529.
18. Dangas GD, Tijssen JGP, Wöhrle J, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382:120-129.
19. Guedeney P, Mehran R, Collet JP, Claessen BE, Ten Berg J, Dangas GD. Antithrombotic Therapy After Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2019;12:e007411.
Autor para correspondencia: Unidad de Hemodinámica y Cardiología Intervencionista, Hospital Universitario Marqués de Valdecilla, Avda. Valdecilla 25, 1.ª Planta, 39008 Santander, Cantabria, España.
Correo electrónico: josemariadela.torre@scsalud.esM (J.M. de la Torre Hernández).