RESUMEN
El ictus después de un implante percutáneo de válvula aórtica es una de las complicaciones más devastadoras. Su etiología es multifactorial y en torno a la mitad de los casos ocurren durante el procedimiento o en el periodo inmediatamente posterior. El uso de dispositivos de protección embólica durante la intervención para prevenir que los émbolos alcancen los vasos cerebrales es una estrategia preventiva muy prometedora para reducir esta complicación. Sin embargo, la evidencia sólida que apoye su uso sistemático todavía es escasa. El estudio REFLECT II es un estudio aleatorizado que evalúa la seguridad y la eficacia de un dispositivo de protección embólica en pacientes que reciben un implante percutáneo de válvula aórtica.
Palabras clave: TAVI. Ictus. Sistemas de protección embólica. Prevención.
Abstract
The occurrence of strokes after transcatheter aortic valve replacement is one of the most devastating complications. It has a multifactorial etiology and nearly half of the events occurr during or immediately after the procedure. The use of periprocedural embolic protection devices to stop the emboli from reaching the cerebral vessels is a promising preventive strategy to reduce this complication. However, we still lack solid evidence supporting its systematic use. The REFLECT II clinical trial is a new randomized clinical trial that assessed the safety and efficacy profile of an embolic protection device in patients undergoing transcatheter aortic valve replacement.
Keywords: TAVI. Stroke. Embolic protection device. Prevention.
Abreviaturas: ACV: accidente cerebrovascular. DPCE: dispositivo de protección cerebral embólica. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El accidente cerebrovascular (ACV) tras el implante percutáneo de válvula aórtica (TAVI) es una de las complicaciones más temidas y devastadoras, si no la más transcendente, por el impacto en la calidad de vida y en la mortalidad de los pacientes. Si bien no es muy frecuente (~3%), su incidencia no ha disminuido de forma paralela a la de otras complicaciones con el desarrollo de la técnica y los nuevos dispositivos, a pesar de los esfuerzos y de las medidas preventivas adoptadas1. Varios estudios utilizando resonancia magnética y Doppler cerebral han demostrado que la gran mayoría de los ACV tras un TAVI tienen un origen embólico desde la propia válvula aórtica2, y al menos la mitad están en estrecha relación temporal con el procedimiento3. Por ello, los dispositivos de protección cerebral embólica (DPCE) han surgido como una estrategia preventiva, a modo de barrera mecánica para proteger el territorio vascular cerebral durante la intervención. Recientemente se han presentado los resultados del estudio REFLECT II (NCT 02536196), un estudio aleatorizado para evaluar la seguridad y la eficacia del DPCE TriGUARD 3 (Keystone Heart Ltd, Caesarea, Israel) en la reducción de eventos clínicos y lesiones cerebrales durante el TAVI4.
ESTUDIO REFLECT II
Se trata de un estudio aleatorizado 2:1 (dispositivo frente a control) con un tamaño muestral estimado de 225 pacientes, aunque por su finalización prematura incluyó 179 pacientes (121 en el grupo del dispositivo y 58 en el grupo control). El objetivo primario de seguridad fue un evento clínico combinado que incluyó muerte, ictus, hemorragia amenazante para la vida, fallo renal agudo en estadio 2 o 3, complicación vascular mayor o reintervención valvular a los 30 días. El objetivo de eficacia por análisis jerárquico incluyó mortalidad o ictus a 30 días, deterioro en la prueba neurológica NIHSS (National Institute of Health Stroke Scale), ausencia de lesiones cerebrales y volumen total en resonancia los 2 a 5 días posteriores al procedimiento. Para el objetivo primario de seguridad se añadieron los datos de 41 pacientes tratados con el dispositivo de la fase inicial de reclutamiento «roll-in» (162 frente a 58), y para el análisis de eficacia se utilizaron además 63 pacientes del grupo control del estudio previo con este dispositivo DEFLECT III (NCT02070731)5 (121 frente a 121 pacientes control). El análisis preespecificado de eficacia por protocolo se estableció en los pacientes que exclusivamente tuviesen una cobertura completa de los 3 troncos cerebrales, que al final se consiguió en 62 (59,3%) pacientes. Las características basales estuvieron bien equilibradas entre ambos grupos, salvo un mayor porcentaje de pacientes con antecedente de ictus en el grupo del dispositivo. Aunque no hubo diferencias estadísticamente significativas en el objetivo primario de seguridad, el porcentaje de eventos fue mayor en el grupo del dispositivo (15,9 frente a 7,0%; p = 0,11), principalmente debido a una mayor incidencia de hemorragia amenazante para la vida (5,7 frente a 0%; p = 0,12) y de complicación vascular mayor (7,0 frente a 0%; p = 0,04) relacionada con el TAVI y no con el DPCE. El objetivo de eficacia también fue similar en los 2 grupos en todos los eventos analizados: mortalidad o ictus a 30 días (9,8 frente a 6,7% en el grupo control; p = 0,475), empeoramiento de la puntuación NIHSS (14,1 frente a 7,6%; p = 0,176), lesiones cerebrales (85,0 frente a 84,9%; p = 1,000) y volumen de las lesiones cerebrales (215,4 frente a 188,1 mm3; p = 0,405) (tabla 1). El volumen total de las lesiones cerebrales fue menor en el análisis por protocolo preespecificado de los pacientes con protección cerebral completa (145,7 frente a 188,1 mm3), pero sin alcanzar la significación estadística.
Tabla 1. Estudios aleatorizados realizados con sistemas de protección cerebral embólica
| Estudio | Año | Dispositivo | N.º total de pacientes/total con DPCE | Objetivo primario | Resultados principales |
|---|---|---|---|---|---|
| EMBOL-X, Wendt et al.6 | 2015 | EMBOL-X (Edwards Lifesciences, Estados Unidos | 30/14 | Lesiones cerebrales nuevas Volumen de lesiones |
|
| DEFLECT III, Lansky et al.5 | 2015 | TriGuard (Keystone Heart Ltd, Israel) | 85/46 | Seguridad y eficacia Objetivo de seguridad: muerte, ictus, hemorragia amenazante para la vida, fallo renal (estadio 2-3), complicación vascular mayor |
|
| MISTRAL-C,Van Mieghem et al.7 | 2016 | SENTINEL (Boston Scientific, Estados Unidos) | 65/32 | Nuevas lesiones cerebrales |
|
| CLEAN-TAVI, Haussig et al.8 | 2016 | SENTINEL (Boston Scientific, Estados Unidos) | 100/50 | Número y volumen de lesiones cerebrales |
|
| SENTINEL, Kapadia et al.9 | 2017 | SENTINEL (Boston Scientific, Estados Unidos) | 363/244 | Seguridad y eficacia clínica (MACCE) del DPCE durante el TAVI |
|
| REFLECT II, Moses4 | 2020 | TriGUARD 3(Keystone Heart Ltd, Israel) | 179/121 | Objetivo de seguridad (evento combinado) a 30 días Objetivo de eficacia (muerte o ictus, deterioro de prueba neurológica, ausencia de lesiones cerebrales y volumen) a 30 días |
|
DPCE: dispositivo de protección cerebral embólica; MACCE: eventos adversos cardiovasculares mayores; NIHSS: National Institute of Health Stroke Scale; TAVI: implante percutáneo de válvula aórtica. | |||||
REFLEXIONES SOBRE EL ENSAYO REFLECT II
El ACV tras un TAVI es un problema complejo y con una etiología multifactorial. Factores propios del paciente, como arritmias auriculares o enfermedad vascular cerebral previa, factores relacionados con el procedimiento, como embolias o inestabilidad hemodinámica, y la terapia antitrombótica posterior, tienen un impacto en diferentes momentos durante y tras el TAVI (figura 1). Los DPCE podrían ayudar a reducir los ACV relacionados con el propio procedimiento. Se han realizado 6 ensayos clínicos aleatorizados (incluyendo los estudios DEFLECT III y REFLECT II) con DPCE en pacientes tratados con TAVI (tabla 1)4-9. La incorporación de este nuevo estudio vuelve a señalar las limitaciones de los estudios aleatorizados previos con DPCE, con un número pequeño de pacientes incluidos y eventos poco frecuentes, y por lo tanto sin potencia suficiente para evaluar diferencias en los resultados clínicos. La gran mayoría de los objetivos primarios incluyeron eventos subrogados a hallazgos en pruebas de imagen (en general incidencia y volumen de nuevas lesiones cerebrales en la resonancia)10.
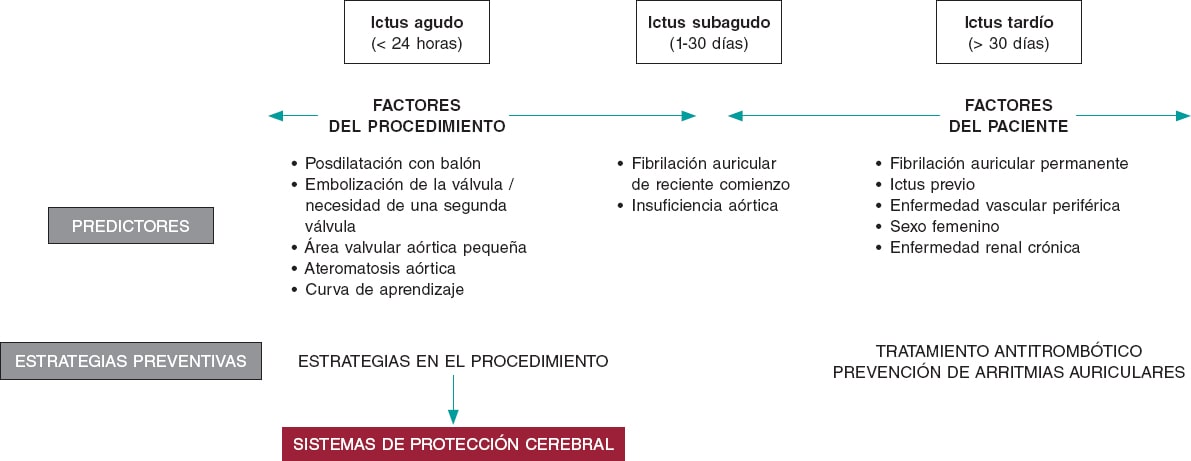
Figura 1. Factores de riesgo de accidentes cerebrovasculares tras un TAVI y posibles estrategias de prevención.
El REFLECT II es un estudio complejo en cuanto a diseño y análisis, con diferentes grupos poblacionales para los objetivos de seguridad y eficacia, junto con múltiples factores interconectados que pueden enmascarar un posible efecto beneficioso del dispositivo. Como en los estudios previos, la tasa de éxito del implante fue muy alta (> 90%) y sin complicaciones graves asociadas. Se debe tener en cuenta que se trata de una estrategia preventiva, por lo que la seguridad debe ser primordial y el número de complicaciones asociadas a su uso debería ser próximo a cero. En términos de eficacia, hay que considerar que el porcentaje de pacientes con cobertura cerebral completa fue bajo (~ 60%), a pesar de que el dispositivo está diseñado para cubrir los 3 troncos supraaórticos. Queda por elucidar si el análisis previo de la tomografía computarizada a nivel del arco y los troncos supraaórticos puede contribuir a seleccionar los mejores candidatos para este dispositivo. En otros estudios, el porcentaje de pacientes con material capturado dentro de los filtros del dispositivo SENTINEL (Boston Scientific, Corp., Estados Unidos) ha sido sistemáticamente alto (> 90%). Otra limitación de este estudio es que se desconocen la cantidad y la naturaleza del material embolizado, dado el propio diseño del dispositivo que actúa como barrera deflectora impidiendo la entrada del material embólico en los troncos supraaórticos. Por último, el resultado neutro del análisis de los 4 objetivos de eficacia apoya más un uso selectivo de los DPCE en pacientes considerados de alto riesgo de eventos embólicos; por ejemplo, con calcificación muy grave de la válvula aórtica o bicúspide, procedimientos valve-in-valve o ictus previo. Es cierto que varios estudios observacionales con comparaciones de cohortes históricas11 y registros con ajuste de propensión de riesgo12 han demostrado una tasa menor de ACV isquémico intrahospitalario (o en las primeras 72 horas) de forma global, pero se trata de estudios con posibles sesgos y limitaciones. Por lo tanto, son necesarios estudios aleatorizados con potencia suficiente que permitan detectar diferencias clínicas para establecer una indicación definitiva de esta medida preventiva. Dos estudios aleatorizados en marcha (PROTECTED TAVR [NCT04149535] y BHF PROTECT-TAVI [ISRCTN16665769]), con un tamaño muestral importante y evaluación sistemática por un especialista en neurología, permitirán aclarar estas dudas. La implicación de un neurólogo en la evaluación de los pacientes es un aspecto trascendental en el diseño de estos estudios, que ayudará a detectar eventos clínicos «silentes» para los no especialistas que pueden conllevar un deterioro neurológico posterior con implicaciones clínicas en el seguimiento a medio y largo plazo, principalmente en pacientes jóvenes y con mayor esperanza de vida.
No hay duda de la importancia y del impacto de los ACV tras un TAVI, y el objetivo final debe ser reducir su incidencia. El propio procedimiento origina que el material embólico migre hacia el territorio cerebral en una gran mayoría de los pacientes. La evidencia actual de los DPCE procedente de los ensayos clínicos aleatorizados se centra en la reducción del volumen de las lesiones cerebrales silentes como un marcador subrogado de enfermedad cerebral. El beneficio clínico de estos dispositivos se basa solo en estudios observacionales, por lo que su uso universal frente al selectivo para la reducción de eventos clínicos está todavía por determinar. Futuros estudios aleatorizados, con un tamaño muestral mayor, con una metodología adecuada y con potencia estadística suficiente para detectar diferencias en eventos clínicos, marcarán el devenir de los DPCE en la prevención de ACV tras un TAVI.
FINANCIACIÓN
No existen fuentes de financiación para este artículo.
CONFLICTO DE INTERESES
L. Nombela-Franco es proctor de Abbott Vascular y ha recibido honorarios por consultoría de Abbott Vascular y Boston Scientific. G. Tirado-Conte no tiene conflictos que declarar.
BIBLIOGRAFÍA
1. Huded CP, Tuzcu EM, Krishnaswamy A, et al. Association Between Transcatheter Aortic Valve Replacement and Early Postprocedural Stroke. JAMA. 2019;321:2306-2315.
2. Armijo G, Nombela-Franco L, Tirado-Conte G. Cerebrovascular events after transcatheter aortic valve implantation. Front Cardiovasc Med. 2018;5:104.
3. Nombela-Franco L, Webb JG, de Jaegere PP, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation. 2012;126:3041-3053.
4. Moses JW. A randomized evaluation of the TriGUARD3 cerebral embolic protection device to reduce the impact of cerebral embolic lesions after transcatheter aortic valve implantation:the REFLECT II trial. En:Transcatheter Cardiovascular Therapeutics 2020 (TCT 2020). October 15, 2020. Disponible en: https://www.tctmd.com/slide/randomized-evaluation-\triguard3tm-cerebral-embolic-protection-device-reduce-impact-cerebral. Consultado 4 Nov 2020.
5. Lansky AJ, Schofer J, Tchetche D, et al. A prospective randomized evaluation of the TriGuard™HDH embolic DEFLECTion device during transcatheter aortic valve implantation:results from the DEFLECT III trial. Eur Heart J. 2015;36:2070-2078.
6. Wendt D, Kleinbongard P, Knipp S, et al. Intraaortic protection from embolization in patients undergoing transaortic transcatheter aortic valve implantation. Ann Thorac Surg. 2015;100:686-691.
7. Van Mieghem NM, van Gils L, Ahmad H, et al. Filter-based cerebral embolic protection with transcatheter aortic valve implantation:the randomised MISTRAL-C trial. EuroIntervention. 2016;12:499-507.
8. Haussig S, Mangner N, Dwyer MG, et al. Effect of a cerebral protection device on brain lesions following transcatheter aortic valve implantation in patients with severe aortic stenosis:the CLEAN-TAVI randomized clinical trial. JAMA. 2016;316:592-601.
9. Kapadia SR, Kodali S, Makkar R, et al. Protection against cerebral embolism during transcatheter aortic valve replacement. J Am Coll Cardiol. 2017;69:367-377.
10. Bagur R, Solo K, Alghofaili S, et al. Cerebral embolic protection devices during transcatheter aortic valve implantation:systematic review and meta-analysis. Stroke. 2017;48:1306-1315.
11. Seeger J, Gonska B, Otto M, et al. Cerebral embolic protection during transfemoral aortic valve replacement significantly reduces death and stroke compared with unprotected procedures. J Am Coll Cardiol Intv. 2017;10:2297-2303.
12. Megaly M, Sorajja P, Cavalcante JL, et al. Ischemic Stroke With Cerebral Protection System During Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020;13:2149-2155.
Autor para correspondencia: Instituto Cardiovascular, Hospital Clínico San Carlos, Instituto de Investigación del Hospital Clínico San Carlos (IdISSC), Prof. Martín Lagos s/n, 28040 Madrid, España.
Correo electrónico: luisnombela@yahoo.com (L. Nombela-Franco).
RESUMEN
El tratamiento antitrombótico tras el implante percutáneo de válvula aórtica (TAVI) ha evolucionado empíricamente, y en la actualidad en las guías clínicas se recomienda el tratamiento antiagregante plaquetario doble (TAPD, ácido acetilsalicílico más clopidogrel). El ensayo piloto ARTE mostró un mayor riesgo de episodios hemorrágicos graves o potencialmente mortales y ninguna disminución de las complicaciones tromboembólicas con el uso de TAPD frente a ácido acetilsalicílico solo en los pacientes receptores de TAVI. El ensayo POPular TAVI recientemente publicado (NCT02247128) ha confirmado los efectos negativos del TAPD (en comparación con el ácido acetilsalicílico solo) tras TAVI, que se asoció con un aumento significativo de todos los eventos hemorrágicos (objetivo principal) y ninguna disminución de los eventos isquémicos (accidente cerebrovascular, infarto de miocardio) ni de las muertes. Además, el TAPD no tuvo ningún efecto sobre la aparición de trombosis valvular clínicamente aparente. Si bien los estudios en curso y futuros determinarán el posible papel de la anticoagulación (frente a la antiagregación plaquetaria) como tratamiento antitrombótico tras TAVI, la evidencia actual apoya firmemente el uso del tratamiento antiagregante plaquetario único (ácido acetilsalicílico) en este contexto. Por lo tanto, en la práctica clínica habitual del TAVI se debe adoptar con urgencia un enfoque minimalista con ácido acetilsalicílico solo, e implementarlo en las guías de práctica clínica.
Palabras clave: Implante percutáneo de válvula aórtica. Terapia antitrombótica. Hemorragias. Ictus.
ABSTRACT
Antithrombotic therapy following transcatheter aortic valve implantation (TAVI) has evolved empirically with dual antiplatelet therapy (DAPT, aspirin plus clopidogrel) currently recommended in the clinical guidelines. The pilot ARTE trial showed a higher risk of major/life-threatening bleeding events and no reduction of thromboembolic complications with the use of DAPT vs aspirin alone in TAVI recipients. The recently published POPular TAVI trial (NCT02247128) confirmed an increased risk of DAPT (vs. aspirin alone) following TAVI, which was associated with a significant increase in all bleeding events (primary endpoint) and no reduction of ischemic events (stroke, myocardial infarction) or death. Also, DAPT had no effects on the occurrence of clinically apparent valve thrombosis. While ongoing and future studies will have to determine the potential role of anticoagulation (vs antiplatelet) therapy as the antithrombotic treatment of TAVI, the evidence currently available strongly supports the use of single antiplatelet therapy (aspirin) in this setting. Thus, a minimalist approach with aspirin alone should urgently be adopted in the TAVI routine clinical practice and, therefore, implemented in the guidelines.
Keywords: transcatheter aortic valve replacement; antithrombotic therapy; bleeding; stroke.
Abbreviations: Abreviaturas TAPD: tratamiento antiagregante plaquetario doble. TAPU: tratamiento antiagregante plaquetario único. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI) se ha convertido en una alternativa al reemplazo quirúrgico convencional de la válvula aórtica en el tratamiento de pacientes ancianos con estenosis aórtica grave1,2. Durante los últimos años, se han producido importantes avances en tecnología valvular percutánea y tratamiento perioperatorio de receptores de TAVI. Sin embargo, todavía no se ha logrado determinar cuál es el tratamiento antitrombótico óptimo tras un TAVI. En 2017, las guías de práctica clínica del American Heart Association/American College of Cardiology (AHA/ACC) recomendaban 75 mg/día de clopidogrel durante los primeros 6 meses tras TAVI seguido de 75-100 mg/día de ácido acetilsalicílico de por vida como el tratamiento de pacientes con valvulopatías3. En 2017, las guías de práctica clínica de la ESC recomendaban tratamiento antiagregante plaquetario doble (TAPD) durante los primeros 3 a 6 meses tras TAVI seguido de tratamiento antiagregante plaquetario único (TAPU) de por vida en pacientes que no precisaban anticoagulación oral por otros motivos4. No obstante, estas recomendaciones se basaban en la opinión de expertos y no en evidencias clínicas sobre los posibles beneficios del TAPD en este contexto.
El ARTE es un estudio aleatorizado piloto que comparó la administración de TAPD y TAPU (ácido acetilsalicílico) durante 3 meses tras TAVI. Este estudio incluyó un total de 222 pacientes y los principales resultados revelaron una incidencia más baja de eventos hemorrágicos mayores/graves en el grupo TAPU sin diferencias en la ocurrencia de eventos isquémicos (infartos de miocardio, accidente cerebrovasculares) o mortalidad tras 3 meses de seguimiento5. Un reciente metanálisis de pacientes que incluyó el estudio ARTE y 2 estudios aleatorizados más pequeños (un total de 421 pacientes, con 210 y 211 pacientes en los grupos TAPD y TAPU, respectivamente) confirmó una incidencia más alta de complicaciones hemorrágicas mayores/graves a los 30 días en el grupo TAPD (del 11,4% frente a 5,2%; odds ratio, 2,24; intervalo de confianza del 95% [IC95%], 1,12-4,46; p = 0,022) sin diferencias en la ocurrencia de accidentes cerebrovasculares (un 2,4% en cada grupo)6. Así pues, se observaron evidencias sólidas de los efectos perjudiciales de TAPD en el contexto TAVI.
EL ESTUDIO POPular TAVI
En el estudio POPular TAVI (cohorte B), recientemente publicado, 665 pacientes tratados con TAVI (y sin una indicación establecida para tratamiento anticoagulante a largo plazo) fueron aleatorizados para recibir clopidogrel (una dosis de carga de 300 mg seguida de 75 mg/día durante 3 meses) y ácido acetilsalicílico (una dosis de carga de 300 mg seguida de 80-10 mg/día de por vida) frente a ácido acetilsalicílico solo (TAPU) de por vida7. Los 2 objetivos primarios fueron hemorragias (mayores, menores y graves o incapacitantes) y hemorragias no asociadas a la intervención durante un periodo de 12 meses. La muerte por causas cardiovasculares o eventos isquémicos (accidente cerebrovascular isquémico, infarto de miocardio) se consideró un objetivo secundario. La edad media de la población del estudio era de 80 años, y la puntuación media en la escala de la Society of Thoracic Surgeons (STS), del 2,5%, respectivamente. Los resultados principales confirmaron una menor incidencia de eventos hemorrágicos y hemorragias no asociadas a la intervención en el grupo TAPU (todas las hemorragias, 15,1% frente al 26,1%; riesgo relativo, 0,57; IC95%, 0,42-0,77; p = 0,001; hemorragias no asociadas a la intervención, 15,1% frente al 24,9%; riesgo relativo = 0,61; IC95%, 0,44-0,83; p = 0,005) sin diferencias entre ambos grupos en lo referente a la ocurrencia de muerte o eventos isquémicos (TAPU, 9,7%; TAPD, 9,9%; p = 0,004 para no inferioridad). El índice de accidentes cerebrovasculares isquémicos durante 12 meses de seguimiento fue similar en los grupos TAPU (5,1%) y TAPD (5,4%).
Por lo tanto, el estudio POPular TAVI ofrece evidencias definitivas de los eventos adversos asociados al uso de TAPD en pacientes tratados con TAVI e insta a cambiar la práctica clínica y las recomendaciones fijadas por las guías de práctica clínica sobre el tratamiento antitrombótico óptimo tras TAVI. Las consideraciones que se hacen a continuación deberían ser importantes para poner en contexto los resultados de este importante estudio y evaluar futuras perspectivas.
Aplicabilidad clínica: del estudio ARTE al POPular TAVI
Se debe considerar que un importante porcentaje de pacientes tratados con TAVI presentaba patologías previas como enfermedad coronaria que precisó del implante de un stent y TAPD o fibrilación auricular que precisó anticoagulación, lo cual excluiría el TAPU como único tratamiento antitrombótico tras la intervención. Lamentablemente, los autores del estudio POPular TAVI no ofrecieron datos sobre el número total de pacientes cribados y finalmente excluidos del estudio. No obstante, según los datos de extensos registros de TAVI8, el porcentaje de pacientes no aptos para esta intervención estaría cercano al 50% en la cohorte de riesgo entre alto y moderado. Además, la incidencia de fibrilación auricular de nueva aparición tras TAVI ronda el 10%9. De hecho, la ocurrencia de esta complicación provocó el cambio de la estrategia antitrombótica (anticoagulación iniciada) en el ~11% de los pacientes de los estudios ARTE y POPular TAVI. Por otro lado, los pacientes incluidos en el estudio ARTE tenían un riesgo quirúrgico entre moderado y alto (puntuación media en la escala STS del 6.3% ± 4.5%). Además, un alto porcentaje de pacientes (~30%) fueron tratados con TAVI mediante abordaje no transfemoral5. No obstante, la mayoría de los pacientes del estudio POPular eran de bajo riesgo quirúrgico y solo en una minoría se empleó un abordaje no transfemoral (~10%). Esto quiere decir que los eventos adversos de TAPD en receptores TAVI se aplicarían a todo el espectro de pacientes de riesgo quirúrgico con independencia del abordaje empleado para la intervención TAVI.
Complicaciones hemorrágicas post-TAVI
Los eventos hemorrágicos siguen siendo una de las complicaciones más frecuentes de TAVI y se asocian a peores resultados10,11. Los ancianos suelen ser candidatos a TAVI y presentar comorbilidades como fragilidad, deterioro de la función renal, anemia o hipertensión que elevan el riesgo de sufrir eventos hemorrágicos8,10,11. Además, el uso de múltiples accesos arteriales (sobre todo transfemorales) y catéteres de gran calibre durante las intervenciones de TAVI contribuye a la ocurrencia de complicaciones vasculares y hemorrágicas en esta población de alto riesgo12,13. Por último, la suma de clopidogrel y ácido acetilsalicílico acarrea un riesgo más alto de sufrir eventos hemorrágicos fuera del contexto de TAVI14-16. Además, el estudio POPular TAVI confirmó que el mayor riesgo de sufrir complicaciones hemorrágicas (incluidas hemorragias mayores/graves) fue incluso más importante en pacientes tratados con TAVI. Como cabía esperar, en los estudios ARTE y POPular TAVI, la mayoría de las complicaciones hemorrágicas descritas se debieron a complicaciones vasculares/en la vía de acceso. No obstante, un gran número de complicaciones se debió a eventos hemorrágicos no asociados a la vía de acceso (el 42% de los eventos hemorrágicos del estudio ARTE se asociaron a hemorragias gastrointestinales subagudas durante las semanas que siguieron a la intervención, todas ellas en el grupo TAPD). Por lo tanto, aunque reducir todavía más el tamaño del catéter y mejorar la homeostasis vascular podrían compensar en parte los eventos adversos asociados al TAPD, el mayor riesgo hemorrágico descrito podría mantenerse incluso después del periodo perioperatorio.
Accidentes cerebrovasculares
La razón de prescribir TAPD a pacientes tratados con TAVI era evitar la ocurrencia de eventos isquémicos, sobre todo accidentes cerebrovasculares, en fase aguda y durante las semanas posteriores a la intervención. No obstante, los resultados de un metanálisis de pacientes (anterior al estudio POPular TAVI) y el propio estudio POPular TAVI revelaron una incidencia similar de accidentes cerebrovasculares isquémicos tanto en el grupo TAPU como en el TAPD6,7. Aunque ninguno de estos estudios estuvo dotado de las herramientas estadísticas necesarias para detectar diferencias entre grupos en lo referente a los eventos isquémicos, no se observó una tendencia favorable al uso de TAPD tras incluir a 1.000 pacientes en estudios aleatorizados (TAPD frente a TAPU). Esto hizo que se planteara la hipótesis de que el posible beneficio del TAPD en el tratamiento de eventos isquémicos cerebrovasculares en este contexto es altamente improbable.
La causa de los eventos cerebrovasculares posteriores al TAVI puede explicar parcialmente la falta de eficacia del TAPD en este contexto. La mayoría de los accidentes cerebrovasculares isquémicos post-TAVI sobrevinieron durante la semana siguiente a la intervención (más de la mitad inmediatamente después de la intervención o durante las siguientes 24 horas17,18). Parece que estos eventos se debieron a la interacción mecánica entre el sistema de implantación percutánea de la válvula aórtica y la válvula nativa enferma con la embolización de múltiples restos (material calcificado, trombos, restos de placa de ateroma) durante la manipulación de guía y catéter19,20. Además, al considerar la ocurrencia de eventos cerebrovasculares durante las primeras 24 horas tras la intervención, un porcentaje importante de eventos se asoció a la ocurrencia de arritmias auriculares17,21 contra las cuales el TAPD ha demostrado poca eficacia. En líneas generales, la fisiopatología de los accidentes cerebrovasculares agudos y subagudos post-TAVI parece escapar al mecanismo de acción del tratamiento antiagregante plaquetario doble con tienopiridinas.
Trombosis valvular
Preocupa la trombosis de la válvula bioprotésica durante las semanas/meses siguientes a la intervención TAVI. No obstante, la ocurrencia de trombosis valvular clínicamente relevante es un evento raro (incidencia < 1%) que tampoco parece verse afectado por el tratamiento con tienopiridinas22,23. El estudio POPular TAVI confirmó el índice muy bajo (< 1%) de trombosis de la válvula protésica clínicamente aparente y la ausencia de efecto del TAPD en la prevención de esta complicación.
Más recientemente, ha aumentado la preocupación en torno a la ocurrencia de trombosis valvular subclínica post-TAVI24. Esta patología sobreviene entre el 10% y el 15% de receptores TAVI y se podría evitar con tratamiento anticoagulante, no con TAPD25.
Anticoagulación frente a antiagregación plaquetaria post-TAVI
Después de establecer la falta de efecto beneficioso del TAPD en receptores de TAVI, cabe preguntarse si el tratamiento anticoagulante (frente al TAPU) tiene algún papel en este contexto. De hecho, las actuales guías de práctica clínica del AHA/ACC y la Sociedad Europea de Cardiología (ESC) sugieren el uso de tratamiento anticoagulante a corto plazo (3 meses) tras el reemplazo quirúrgico de válvula aórtica (recomendaciones IIb y IIa, respectivamente)3,4. Algunos estudios con monitorización ecocardiográfica continua post-TAVI han reportado una alta incidencia (cercana al 20%) de episodios silentes de fibrilación auricular durante las semanas/meses que siguen a la intervención26. Administrar tratamiento anticoagulante puede resultar más efectivo para prevenir la ocurrencia de eventos tromboembólicos en estos pacientes. Cabe destacar que Muntané-Carol et al.27 confirmaron recientemente un mayor riesgo de accidentes cerebrovasculares tardíos post-TAVI (> 1 mes) en pacientes que no están en tratamiento anticoagulante, lo cual apunta a los posibles beneficios derivados de dicha estrategia. Además, datos recientes han revelado el papel del tratamiento anticoagulante en la prevención de la trombosis valvular subclínica tal y como confirman las tomografías computarizadas en 4D25,28. Así pues, habría una base mecanística que avalaría el papel del tratamiento anticoagulante en este contexto. No obstante, todavía está por ver cuáles son las consecuencias clínicas de la trombosis valvular subclínica y el hecho de que, a diferencia del TAPU, los beneficios clínicos que genera la anticoagulación podrían verse contrarrestados por un mayor riesgo de eventos hemorrágicos.
El estudio GALILEO comparó una estrategia de anticoagulación sistemática post-TAVI (rivaroxabán 10 mg/día más ácido acetilsalicílico durante los primeros 3 meses) para evitar la muerte o los eventos tromboembólicos29. No obstante, el estudio finalizó prematuramente por problemas de seguridad y los resultados revelaron un mayor riesgo de muerte/eventos tromboembólicos así como una incidencia más alta de hemorragias mayores/graves derivadas del uso de rivaroxabán. El estudio actualmente en activo ATLANTIS (estrategia antitrombótica tras implantación percutánea de valvula aórtica para el tratamiento de la estenosis aórtica; NCT02664649), un estudio de 3 grupos que comparó el apixabán con el TAPD con el TAPU (ácido acetilsalicílico) en pacientes sin indicación clínica para anticoagulación debería arrojar algo de luz (probablemente de un modo definitivo) sobre el verdadero papel del tratamiento anticoagulante en receptores TAVI30.
CONCLUSIONES
En conclusión, el estudio POPular TAVI confirmó los efectos perjudiciales del TAPD (frente a TAPU) tras TAVI, lo cual supone un importante paso adelante a la hora de determinar la estrategia antitrombótica óptima en este contexto. Los estudios que se realicen en el futuro deberán valorar si la anticoagulación sistemática (y su duración, ¿a corto plazo, quizá?) ha de ser superior al TAPU para obtener mejores resultados. Se debe mencionar que los eventos clínicos (incluidas las complicaciones hemorrágicas), y no las características de las imágenes subclínicas, deberían guiar el proceso de toma de decisiones en la estrategia trombótica que se debe seguir tras TAVI. Entre tanto, en la práctica clínica habitual de TAVI se debería adoptar urgentemente un abordaje minimalista con ácido acetilsalicílico solo, que se debería incluir en las guías de práctica clínica.
CONFLICTO DE INTERESES
J. Rodés-Cabau dijo haber recibido ayudas institucionales a la investigación de Edwards Lifesciences, Medtronic y Boston Scientific.
AGRADECIMIENTOS
J. Rodés-Cabau ocupa la cátedra de investigación canadiense Fondation Famille Jacques Larivière para el desarrollo de intervenciones de cardiopatías estructurales (Laval University, Ciudad de Quebec, Canadá).
BIBLIOGRAFÍA
1. Puri R, Chamandi C, Rodriguez-Gabella T, Rodes-Cabau J. Future of transcatheter aortic valve implantation - Evolving clinical implications. Nat Rev Cardiol. 2018;15:57-65.
2. Kolte D, Vlahakes GJ, Palacios IF, et al. Transcatheter Versus Surgical Aortic Valve Replacement in Low-Risk Patients. J Am Coll Cardiol. 2019;74:1532–1540.
3. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2017;70:252-289.
4. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
5. Rodes-Cabau J, Masson JB, Welsh RC, et al. Aspirin Versus Aspirin Plus Clopidogrel as Antithrombotic Treatment Following Transcatheter Aortic Valve Replacement With a Balloon-Expandable Valve:The ARTE (Aspirin Versus Aspirin +Clopidogrel Following Transcatheter Aortic Valve Implantation) Randomized Clinical Trial. JACC Cardiovasc Interv. 2017;10:1357-1365.
6. Maes F, Stabile E, Ussia GP, et al. Meta-Analysis Comparing Single Versus Dual Antiplatelet Therapy Following Transcatheter Aortic Valve Implantation. Am J Cardiol. 2018;122:310-315.
7. Brouwer J, Nijenhuis R, Delewi RS, et al. Aspirin with or without clopidogrel after transcatheter aortic-valve implantation. N Engl J Med 2020. https://doi.org/10.1056/NEJMoa2017815.
8. Holmes DR, Brennan JM, Rumsfeld JS, et al. Clinical outcomes at 1 year following transcatheter aortic valve replacement. JAMA 2015;313:1019-1028.
9. Mok M, Urena M, Nombela-Franco L, et al. Clinical and prognostic implications of existing and new-onset atrial fibrillation in patients undergoing transcatheter aortic valve implantation. J Thromb Thrombolysis. 2013;35:450-455.
10. Genereux P, Head SJ, Van Mieghem NM, et al. Clinical outcomes after transcatheter aortic valve replacement using valve academic research consortium definitions:a weighted meta-analysis of 3,519 patients from 16 studies. J Am Coll Cardiol. 2012;59:2317-2326.
11. Rodes-Cabau J, Dauerman HL, Cohen MG, et al. Antithrombotic treatment in transcatheter aortic valve implantation:insights for cerebrovascular and bleeding events. J Am Coll Cardiol. 2013;62:2349-2359.
12. Redfors B, Watson BM, McAndrew T, et al. Mortality, Length of Stay, and Cost Implications of Procedural Bleeding After Percutaneous Interventions Using Large-Bore Catheters. JAMA Cardiol. 2017;2:798-802.
13. Junquera L, Urena M, Latib A, et al. Comparison of Transfemoral Versus Transradial Secondary Access in Transcatheter Aortic Valve Replacement. Circ Cardiovasc Interv. 2020;13:e00↡.
14. Shehab N, Sperling LS, Kegler SR, Budnitz DS. National estimates of emergency department visits for hemorrhage-related adverse events from clopidogrel plus aspirin and from warfarin. Arch Intern Med. 2010;170:1926-1933.
15. Delaney JA, Opatrny L, Brophy JM, Suissa S. Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding. CMAJ. 2007;177:347-351.
16. Miyazaki Y, Suwannasom P, Sotomi Y, et al. Single or dual antiplatelet therapy after PCI. Nat Rev Cardiol. 2017;14:294-303.
17. Nombela-Franco L, Webb JG, de Jaegere PP, et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation. 2012;126:3041-3053.
18. Miller DC, Blackstone EH, Mack MJ, et al. Transcatheter (TAVR) versus surgical (AVR) aortic valve replacement:occurrence, hazard, risk factors, and consequences of neurologic events in the PARTNER trial. J Thorac Cardiovasc Surg. 2012;143:832-843.e813.
19. Van Mieghem NM, Schipper ME, Ladich E, et al. Histopathology of embolic debris captured during transcatheter aortic valve replacement. Circulation. 2013;127:2194-2201.
20. Kahlert P, Al-Rashid F, Dottger P, et al. Cerebral embolization during transcatheter aortic valve implantation:a transcranial Doppler study. Circulation. 2012;126:1245-1255.
21. Auffret V, Regueiro A, Del Trigo M, et al. Predictors of Early Cerebrovascular Events in Patients With Aortic Stenosis Undergoing Transcatheter Aortic Valve Replacement. J Am Coll Cardiol. 2016;68:673-684.
22. Cordoba-Soriano JG, Puri R, Amat-Santos I, et al. Valve thrombosis following transcatheter aortic valve implantation:a systematic review. Rev Esp Cardiol. 2015;68:198-204.
23. Latib A, Naganuma T, Abdel-Wahab M, et al. Treatment and clinical outcomes of transcatheter heart valve thrombosis. Circ Cardiovasc Interv. 2015;8:e001779.
24. Puri R, Auffret V, Rodes-Cabau J. Bioprosthetic Valve Thrombosis. J Am Coll Cardiol. 2017;69:2193-2211.
25. Chakravarty T, Sondergaard L, Friedman J, et al.;RESOLVE and SAVORY Investigators. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves:an observational study. Lancet. 2017;389:2383-2392.
26. Rodés-Cabau J, Urena M, Nombela-Franco L, et al. Arrhythmic Burden as Determined by Ambulatory Continuous Cardiac Monitoring in Patients With New-Onset Persistent Left Bundle Branch Block Following Transcatheter Aortic Valve Replacement:The MARE Study. JACC Cardiovasc Interv. 2018;11:1495-1505.
27. Muntané-Carol G, Urena M, Munoz-Garcia A, et al. Late Cerebrovascular Events Following Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2020;13:872-881.
28. De Backer O, Dangas GD, Jilaihawi H, et al. Reduced Leaflet Motion after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382:130-139.
29. Dangas GD, Tijssen JGP, Wöhrle J, et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020;382:120-129.
30. Collet JP, Berti S, Cequier A, et al. Oral anti-Xa anticoagulation after trans-aortic valve implantation for aortic stenosis:The randomized ATLANTIS trial. Am Heart J. 2018;200:44-50.
Autor para correspondencia: Quebec Heart and Lung Institute, Laval University, 2725 Ch Ste-Foy, G1V4G5 Ciudad de Quebec, Quebec, Canadá.
Correo electrónico: josep.rodes@criucpq.ulaval.ca (J. Rodés-Cabau).
https://doi.org/10.24875/RECIC.M20000170
RESUMEN
El estudio ISCHEMIA, cuyos resultados se presentaron en el congreso de la American Heart Association en 2019, tiene como objetivo principal determinar si una estrategia invasiva inicial de cateterización cardiaca y revascularización exitosa, junto con el tratamiento médico óptimo, reduce el objetivo primario combinado de muerte cardiovascular o infarto de miocardio en pacientes con síndrome coronario crónico, en comparación con una estrategia conservadora inicial de tratamiento médico óptimo. De 5.179 pacientes, se aleatorizaron 2.588 para seguir una estrategia invasiva y 2.591 para una estrategia conservadora. A los 4 años de seguimiento, el objetivo primario no mostró diferencias significativas entre ambos grupos, lo que generó un gran revuelo mediático. En nuestra opinión, debemos ser prudentes al interpretar los resultados de un estudio aún sin publicar. No obstante, es innegable que el estudio ISCHEMIA aborda la importante cuestión de que el tratamiento médico más potente en pacientes con síndrome coronario crónico ha demostrado modificar la evolución natural de la enfermedad.
Palabras clave: Estrategia conservadora. Estrategia invasiva. Síndrome coronario crónico.
ABSTRACT
The primary endpoint of the ISCHEMIA trial, whose results were presented at the American Heart Association congress back in 2019, was to determine whether an initial invasive strategy of cardiac catheterization and successful revascularization plus optimal medical treatment would reduce the primary composite endpoint of cardiovascular death or myocardial infarction in patients with chronic coronary syndrome compared to an initial conservative strategy of optimal medical treatment. Out of 5179 patients, 2588 were randomized to receive an invasive strategy and 2591 to receive conservative strategy. At the 4-year follow-up, the primary endpoint showed no significant differences between both groups revolutionizing mass media. In our opinion, we should be cautious when interpreting the results of a study that has not been published yet. There is no doubt, however, that the ISCHEMIA trial deals with an important matter, that the most powerful medical treatment was able to modify the natural history of this disease in patients with chronic coronary syndrome.
Keywords: Chronic coronary syndrome. Conservative strategy. Invasive strategy.
Abreviaturas: CON: estrategia conservadora; ICP: intervención coronaria percutánea; INV: estrategia invasiva; SCC: síndrome coronario crónico; TMO: tratamiento médico óptimo.
INTRODUCCIÓN
Según las recomendaciones actuales de las guías de práctica clínica, en los pacientes con síndromes coronarios crónicos (SCC) el tratamiento médico óptimo (TMO) es fundamental para mejorar los síntomas, reducir la progresión de la aterosclerosis y prevenir los eventos aterotrombóticos. La revascularización coronaria desempeña un papel fundamental en el abordaje de estos pacientes, como tratamiento complementario al TMO. Asimismo, en estudios clásicos ha demostrado tanto un alivio de la sintomatología como una mejora del pronóstico1-3. Sin embargo, en estudios contemporáneos los beneficios de la revascularización sistemática en pacientes con SCC han sido cuestionados por las tasas similares de muerte y de infarto de miocardio observadas en los tratados con TMO con y sin intervención coronaria percutánea (ICP) en el ensayo COURAGE4, y con y sin ICP o revascularización coronaria quirúrgica en el ensayo BARI 2D5. Estos estudios presentan unas características comunes que los investigadores del ensayo ISCHEMIA (NCT01471522) han tenido muy en cuenta al diseñar el estudio: a) hay un sesgo de selección en ambos estudios, ya que la aleatorización se realiza tras conocer la anatomía coronaria; b) entre los criterios de inclusión no se requiere un umbral mínimo de isquemia miocárdica; y c) solo se utilizaron stents recubiertos en un número muy pequeño de pacientes.
DISEÑO Y OBJETIVOS DEL ESTUDIO
El objetivo principal original del estudio ISCHEMIA fue determinar si una estrategia invasiva inicial (INV) de cateterización cardiaca y revascularización exitosa (con ICP o revascularización quirúrgica), junto con el TMO, reduciría el objetivo primario combinado de muerte cardiovascular o infarto de miocardio en pacientes con SCC e isquemia moderada o grave (con síntomas médicamente controlables o ausentes), en comparación con una estrategia conservadora inicial (CON) de TMO únicamente, reservando la cateterización para los casos de fracaso del TMO (figura 1). Los objetivos secundarios fueron la muerte cardiovascular o el infarto de miocardio, y objetivos de calidad de vida. El estudio se inició en julio de 2012, y en junio de 2017, ante la baja tasa de eventos, el panel de asesores independientes del National Heart, Lung, and Blood Institute (NHLBI) decidió modificar el doble objetivo primario del estudio por un combinado de 5 variables: muerte cardiovascular, infarto de miocardio, parada cardiaca resucitada y hospitalización por angina inestable o insuficiencia cardiaca6. La mediana de seguimiento fue de 3,3 años.
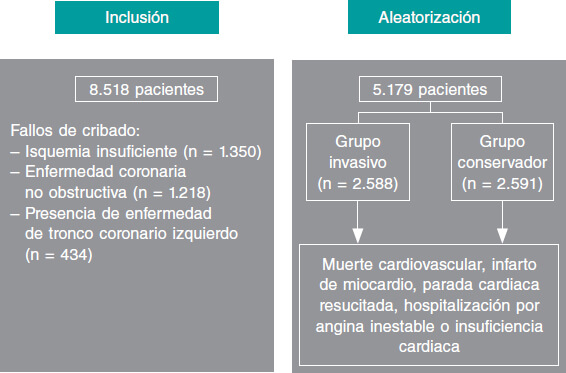
Figura 1. Flujo de pacientes desde la inclusión hasta la aleatorización.
Como puntos interesantes del diseño del estudio podemos destacar:
- - El grado de isquemia para valorar si un paciente cumplía los requisitos del estudio se establecía según unos criterios predefinidos utilizando alguna de las siguientes exploraciones complementarias: estudios de medicina nuclear, ecocardiograma de estrés, resonancia magnética cardiaca o ergometría.
- - Los principales criterios de exclusión incluían la presencia de insuficiencia cardiaca, síndrome coronario agudo o revascularización recientes, fracción de eyección del ventrículo izquierdo < 35%, estenosis del tronco coronario > 50% (el estudio requería realizar una tomografía computarizada previamente a la aleatorización) o angina no controlada al inicio del estudio, a pesar de recibir tratamiento médico máximo.
RESULTADOS
De 8.518 pacientes cribados, se aleatorizó a 5.179 para seguir una estrategia INV (n = 2.588) o CON (n = 2.591), y se hizo un seguimiento durante una mediana de 3,3 años (figura 1). Las características basales de ambos grupos no diferían de manera significativa7,8. La edad media fue de 64 años y el 23% de los pacientes eran mujeres. La fracción de eyección media era del 60%. En el 75% de los casos se realizó un test de isquemia con imágenes y en el 25% restante se realizó una ergometría. De los pacientes aleatorizados, un laboratorio centralizado determinó que el 54% tenían isquemia grave, un 33% moderada, un 12% ligera o ausente, y un 1% no interpretable. Entre los pacientes de la rama INV se revascularizó al 80%; el 74% mediante ICP y el resto mediante cirugía de revascularización coronaria. De los pacientes no revascularizados, dos tercios no tenían enfermedad coronaria significativa y un tercio presentaban enfermedad coronaria extensa no revascularizable.
El objetivo primario del estudio a 4 años de seguimiento se presentó en el 15,5% y el 13,6%, en las ramas CON e INV, respectivamente, sin diferencias significativas (hazard ratio [HR] ajustado = 0,93 [0,8-1,08]; p = 0,34). Hubo una tendencia a una mayor tasa de eventos en los primeros 6 meses para la rama INV, que se invirtió a favor de esta a los 2 años de seguimiento. En cuanto al infarto de miocardio, el espontáneo se redujo en la rama INV (HR ajustado = 0,67 [0,53-0,83]; p < 0,01), mientras que el periprocedimiento fue mayor en esta rama (HR ajustado = 2,98 [1,87-4,74]; p < 0,01).
COMENTARIO
El estudio ISCHEMIA se presentó en 3 sesiones de late breaking clinical trials del congreso de la American Heart Association celebrado en Filadelfia en noviembre de 2019: resultados clínicos, de calidad de vida y resultados en pacientes con enfermedad renal avanzada7. Desde entonces se ha generado un gran revuelo mediático9, con la consiguiente preocupación por parte de varios colectivos de pacientes ante un mensaje que se les ha transmitido en diferentes medios: «a miles de pacientes se les está sometiendo a procedimientos innecesarios».
En nuestra opinión, debemos ser prudentes al interpretar los resultados de un estudio que ha causado tal revuelo, sin que dichos resultados estén aún publicados. Lo que es innegable, y de elogio a los investigadores, es que ISCHEMIA ha investigado una importante cuestión: el abordaje de pacientes con enfermedad coronaria estable (ahora denominado SCC) con el tratamiento médico más potente que ha demostrado modificar la evolución natural de la enfermedad.
De toda la información disponible del estudio, destacaríamos 4 puntos:
- - Fue un estudio bastante difícil de llevar a cabo, en el que la inclusión de pacientes fue muy lenta en la mayoría de los centros participantes. Por ello, antes de llegar al 50% de los eventos calculados para el objetivo primario del estudio, este se tuvo que cambiar para poder aumentar así el número de eventos, lo cual es una práctica no deseable al realizar un estudio10.
- - Los criterios de inclusión fueron muy rigurosos. Para poder incluir un paciente debía demostrase la presencia de enfermedad coronaria en una tomografía computarizada (estudio anatómico) y posteriormente demostrar isquemia significativa (estudio funcional, el 50% de los aleatorizados mediante estudios de medicina nuclear), algo poco habitual en el abordaje de estos pacientes en nuestro medio.
- - Por otra parte, ISCHEMIA es un estudio sobre el abordaje de pacientes con enfermedad coronaria estable, y no sobre revascularización frente a no revascularización, tal como se anunció en muchos medios. Este aspecto queda muy claro si se analizan los siguientes datos: solo se revascularizó al 80% de los pacientes del grupo INV y hasta el 23% de los sujetos asignados al grupo CON recibió revascularización. Tampoco ISCHEMIA es un estudio de ICP, ya que solo el 74% de los pacientes sometidos a revascularización fueron tratados con esta técnica, mientras que la cirugía de revascularización coronaria se realizó en el resto de los casos. Esto significa que 1 de cada 5 pacientes del grupo INV no recibió revascularización y 1 de cada 4 pacientes en el grupo CON se sometió a revascularización.
- - Los resultados principales del estudio muestran que, al comparar ambas estrategias, existen riesgos similares de presentar el objetivo combinado de muerte cardiovascular, infarto de miocardio, parada cardiaca resucitada y hospitalización por angina inestable o insuficiencia cardiaca. Analizando el resto de los objetivos del estudio se puede afirmar que una estrategia CON conlleva menor riesgo de presentar infarto de miocardio periprocedimiento (por razones obvias) u hospitalización por insuficiencia cardiaca, mientras que una estrategia inicial INV conlleva menor riesgo de padecer infarto de miocardio espontáneo u hospitalización por angina inestable, y se asocia a un innegable beneficio sintomático y una mejora de la calidad de vida en los pacientes con síntomas anginosos. Al analizar los acontecimientos adversos es evidente que el infarto de miocardio periprocedimiento no presenta el mismo valor pronóstico que el infarto de miocardio espontáneo. Además, tanto las curvas del infarto de miocardio espontáneo como el criterio de valoración primario siguen divergiendo al final del seguimiento, lo que favorece la estrategia de revascularización, a pesar del gran número de pacientes del grupo CON que se sometieron a ella, por lo que será muy importante ver los resultados a más largo plazo.
En resumen, ISCHEMIA es un estudio histórico que sin duda restablece la importancia del manejo médico agresivo en los pacientes con enfermedad coronaria estable. Sin embargo, antes de declararlo una victoria contra la revascularización hay que ser consciente de la mejora de la calidad de vida que ofrece la revascularización y de las limitaciones inherentes de un estudio aún no publicado, algunas de las cuales se han comentado en este artículo.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
2. Fleg JL, Forman DE, Berra K, et al. Secondary prevention of atherosclerotic cardiovascular disease in older adults:a scientific statement from the American Heart Association. Circulation. 2013;128:2422-2446.
3. Hachamovitch R, Rozanski A, Shaw LJ, et al. Impact of ischaemia and scar on the therapeutic benefit derived from myocardial revascularization vs. medical therapy among patients undergoing stress-rest myocardial perfusion scintigraphy. Eur Heart J. 2011;32:1012-1024.
4. Boden WE, O'Rourke RA, Teo KK, et al.;COURAGE Trial Research Group. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med. 2007;356:1503-1516.
5. BARI 2D Study Group. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med. 2009;360:2503-2515.
6. ISCHEMIA Trial Research Group, Maron DJ, Hochman JS, et al. International Study of Comparative Health Effectiveness with Medical and Invasive Approaches (ISCHEMIA) trial:Rationale and design. Am Heart J. 2018;201:124-135.
7. American Heart Association. International Study of Comparative Health Effectiveness With Medical and Invasive Approaches (ISCHEMIA). Disponible en:https://professional.heart.org/professional/ScienceNews/UCM_505226_ISCHEMIA-Clinical-Trial-Details.jsp. Consultado 20 Ene 2020.
8. Hochman JS, Reynolds HR, Bangalore S, et al. Baseline Characteristics and Risk Profiles of Participants in the ISCHEMIA Randomized Clinical Trial. JAMA Cardiol. 2019;4:273-286.
9. Biondi-Zoccai G, Frati G, Romagnoli E, et al. Final results of the ISCHEMIA trial:distinguishing mass media coverage from clinical interpretation. Minerva Cardioangiol. 2019. https://doi.org/10.23736/S0026-4725.19.05106-5.
10. Maron DJ, Harrington RA, Hochman JS. Planning and Conducting the ISCHEMIA Trial. Circulation. 2018;138:1384-1386.
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Central de Asturias. Av. Roma, 33011 Oviedo, Asturias, España.
Correo electrónico: avanzas@secardiologia.es (P. Avanzas).
INTRODUCCIÓN
A partir de la alarma generada por el incremento del número de casos de trombosis tardía tras el implante de stents farmacoactivos en 20051, se recomendó 1 año de tratamiento antiagregante plaquetario doble (TAPD) después de dicho implante. La reducción en la tasa de esta complicación derivada de la mejoría en el diseño de los dispositivos ha permitido un acortamiento del TAPD. Las pautas más cortas de TAPD están siendo objeto de estudio2-4 (figura 1) y se ha llegado al TAPD de tan solo 1 mes con posterior suspensión de uno de los 2 fármacos. No obstante, la mayoría de los estudios con TAPD de 1 mes se han realizado en pacientes de bajo riesgo5,6 o se han centrado en pacientes con cardiopatía isquémica estable7.
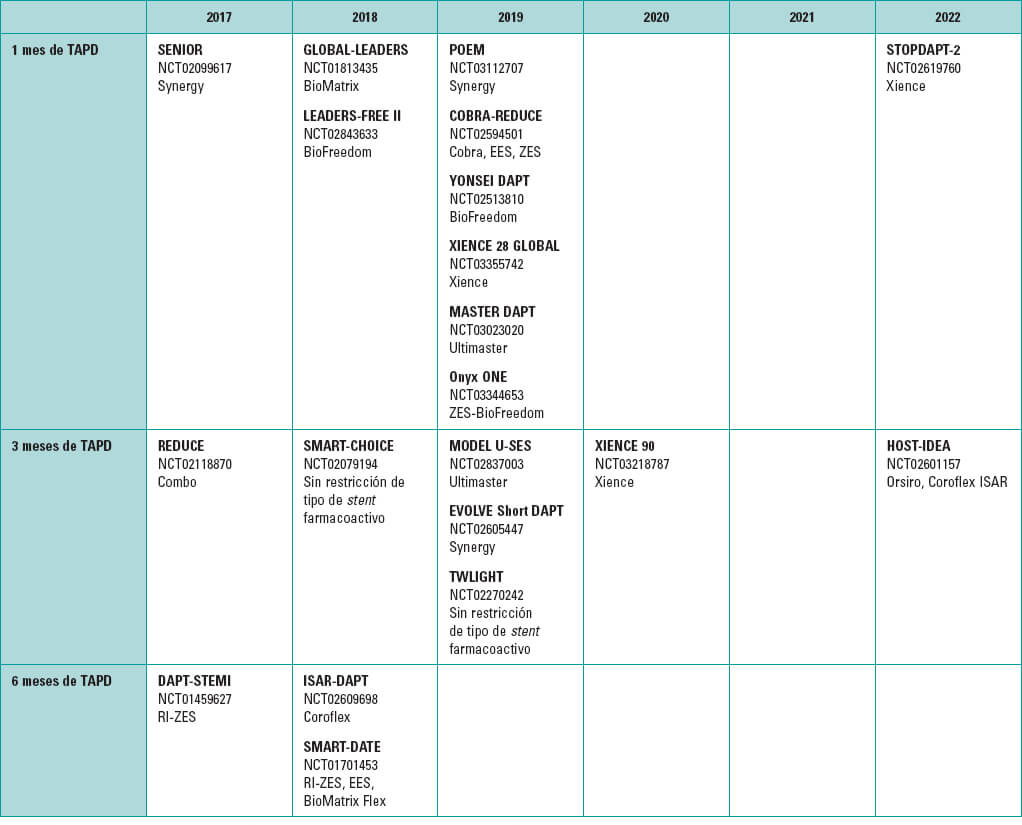
Figura 1. Estudios con pautas cortas de doble antiagregación. TAPD: tratamiento antiagregante plaquetario doble.
Con el envejecimiento progresivo de la población, la comorbilidad y el incremento de la incidencia de fibrilación auricular, cada vez es más frecuente encontrar pacientes con alto riesgo de sangrado, cuya frecuencia se estima en un 15%8. En el estudio LEADERS FREE9, el stent BioFreedom con biolimus A9 (Biosensors, Suiza) sin polímero y plataforma de acero inoxidable se mostró superior a su homólogo convencional en pacientes con alto riesgo de sangrado y con TAPD con clopidogrel durante tan solo 1 mes, y desde entonces este dispositivo se situó como la referencia en este tipo de pacientes.
El stent Resolute Onyx de cromo-cobalto con zotarolimus y polímero permanente (Medtronic, Estados Unidos) tenía hasta la fecha datos de seguridad con 1 mes de TAPD10, pero no se disponía de un estudio aleatorizado específicamente con este motivo. Sí había datos en este contexto con un modelo previo con zotarolimus, el Endeavor Sprint (Medtronic, Estados Unidos), pero con una cinética de liberación diferente y no disponible en el mercado desde hace varios años11. En el estudio Onyx ONE (NCT03344653), el stent Resolute Onyx se comparó con el stent BioFreedom en pacientes con algo riesgo de sangrado, y el objetivo de esta revisión es analizar dicho estudio y contextualizarlo con los estudios recientes con regímenes de TAPD de 1 mes.
DISEÑO
El Onyx ONE es un estudio prospectivo, aleatorizado y multicéntrico para comparar la seguridad y la eficacia del stent Resolute Onyx de plataforma de cromo-cobalto, polímero permanente y zotarolimus, con el stent BioFredom de acero con biolimus A9 y sin polímero, en pacientes con alto riesgo de sangrado y régimen de TAPD de 1 mes.
El objetivo primario fue el compuesto de muerte cardiaca, infarto y trombosis definitiva o probable a 1 año. El objetivo secundario, para el que la potencia del ensayo estaba calculada, era el fallo de la lesión, definido como los anteriores más revascularización de la lesión por causa isquémica. Otros objetivos secundarios fueron el éxito del vaso, del dispositivo y del procedimiento, el sangrado BARC (Bleeding Academic Research Consortium Definition of Bleeding) y los componentes del objetivo primario por separado. Los criterios de inclusión se detallan en la tabla 1, son exactamente los mismos que los empleados en el estudio LEADERS FREE9 y están centrados en los pacientes con alto riesgo de sangrado.
Tabla 1. Criterios de inclusión del estudio Onyx ONE
| Indicación de intervención coronaria percutánea y al menos uno de los siguientes criterios: |
|---|
| Edad ≥ 75 años |
| Anticoagulación oral tras el implante del stent |
| Hemoglobina 11 g/l o transfusión en las 4 semanas previas |
| Plaquetas < 100.000/mm3 |
| Ingreso hospitalario por sangrado en los 12 meses previos |
| Ictus en los 12 meses previos |
| Antecedentes de hemorragia intracraneal |
| Enfermedad hepática grave |
| Aclaramiento de creatinina < 40 ml/min |
| Cáncer en los 3 años previos |
| Cirugía programada en los 12 meses siguientes |
| Corticoides o antiinflamatorios no esteroideos en el primer mes tras el implante del stent |
Dudosa adherencia a la terapia de doble antiagregación plaquetaria a partir del primer mes |
Un aspecto crucial en este estudio es el régimen antitrombótico. En el primer mes, todos los pacientes debían recibir 75-100 mg/día de ácido acetilsalicílico (AAS) y un inhibidor de los receptores P2Y12, preferentemente clopidogrel. En aquellos con anticoagulación oral, en este primer mes se permitía terapia simple o TAPD. A partir del primer mes, uno de los 2 antiagregantes se suspendía, sin preferencia por uno u otro.
Su diseño de no inferioridad incluyó a 2.000 pacientes con aleatorización 1:1, con una tasa de eventos calculados en cada rama del 9,4% para el objetivo primario y un margen de no inferioridad del 4,1%. En un tiempo récord, entre noviembre de 2017 y septiembre de 2018, se consiguió completar el estudio con 1.996 pacientes, con un seguimiento al año cercano al 98% en ambos grupos.
RESULTADOS
La edad media en ambos grupos superaba los 74 años, con un porcentaje de diabéticos superior al 38%. Cerca de la tercera parte presentaban fibrilación auricular y la indicación se repartió a partes iguales entre el grupo de estables y los de síndrome coronario agudo (SCA), aunque solo el 5% tenía elevación del ST. Los 4 criterios de inclusión más frecuentes fueron la edad ≥ 75 años (61% de los pacientes), la anticoagulación oral (38%), la anemia o la transfusión en el último año (15%), y el aclaramiento de creatinina < 40 ml/min (15%).
Las lesiones fueron de tipo B2 o C en el 80% de los casos, con una longitud de vaso cubierta por el stent de 37 mm. No hubo diferencias en el éxito de la lesión y del procedimiento, pero el grupo del stent Resolute Onyx obtuvo mejor resultado en el éxito del dispositivo, con un cruce desde su grupo al de BioFreedom en 2 casos, pero con 40 en la dirección contraria. Por otra parte, el stent de zotarolimus también mostró diferencias significativas, con menor estenosis residual y mayor ganancia angiográfica inicial.
Al cabo de 2 meses del procedimiento, el 92% de los pacientes recibían antiagregación simple, un 56% de ellos con ácido AAS y un 44% con clopidogrel. Estos mismos porcentajes se mantenían al año, momento en que el 88% seguían recibiendo monoterapia.
El objetivo primario de no inferioridad se cumplió, con una tasa de eventos del 17,1% en el grupo de Resolute Onyx y del 16,9% en el de BioFreedom (diferencia del 0,2%, límite superior del intervalo de confianza = 3,0%; p de no inferioridad = 0,011). No se encontraron diferencias significativas en la tasa de eventos de cada componente del objetivo primario por separado ni en el objetivo secundario de fallo de la lesión. Finalmente, tampoco hubo diferencias en las tasas de sangrado BARC (tabla 2).
Tabla 2. Resultados a 12 meses del estudio Onyx ONE
| Resolute Onyx | BioFreedom | p | |
|---|---|---|---|
| Muerte cardiaca, infarto, trombosis del stent | 17,1 | 16,9 | 0,84 |
| Muerte cardiaca | 4,6 | 3,9 | 0,40 |
| Infarto | 13,5 | 15 | 0,50 |
| Periprocedimiento | 9,4 | 7,9 | 0,26 |
| Espontáneo en el seguimiento | 4,6 | 7,1 | 0,02 |
| Trombosis probable o definitiva | 1,3 | 2,1 | 0,22 |
| Precoz (primer mes) | 0,6 | 1,3 | |
| Tardía (entre el primer mes y 1 año) | 0,7 | 0,7 | |
| Fallo de la lesión | 18 | 17,9 | 0,84 |
| Muerte cardiaca | 4,5 | 3,7 | 0,43 |
| Infarto atribuible a la lesión tratada | 12,8 | 14,0 | 0,43 |
| Revascularización guiada por isquemia | 2,8 | 4,0 | 0,17 |
| Éxito del dispositivo | 92,8 | 89,7 | 0,007 |
| Sangrado BARC | |||
| 1-5 | 17,7 | 16,3 | 0,43 |
| 2-5 | 15,1 | 13,7 | 0,40 |
| 3-5 | 4,5 | 4,9 | 0,67 |
BARC: Bleeding Academic Research Consortium Definition of Bleeding. | |||
DISCUSIÓN
¿Quién es el ganador en este estudio?
En resumen, se puede considerar que los resultados obtenidos han sido similares con ambos stents, exceptuando un mayor éxito del dispositivo con el Resolute Onyx, por menor tasa de cruce. Este hecho no es algo inesperado, dadas las diferencias en el diseño de las plataformas, pues el Resolute Onyx es un monofilamento sinusoidal compuesto por una carcasa externa de aleación de cobalto y un núcleo interno de un 90% de platino y un 10% de aleación de iridio, con un grosor de malla de 81 μm, mientras que el BioFreedom tiene un diseño más antiguo, con acero inoxidable 316-L y de 120 μm. Sin embargo, en el momento actual, ambos stents son los únicos dispositivos con evidencia en pacientes con alto riesgo de sangrado, y se puede considerar que los dos han salido beneficiados con estos resultados. Por una parte, el estudio Onyx ONE viene a confirmar los buenos resultados del BioFreedom obtenidos en el ensayo LEADERS FREE, y de alguna manera sirve para responder a las críticas basadas en la calidad del stent convencional utilizado, cuyo grosor de strut estaba muy por encima del de otros existentes en el mercado. Por otra parte, el Resolute Onyx partía de buenos datos en caso de tener que suspender el TAPD después del primer mes10, pero dichos datos provenían de estudios no diseñados para este objetivo y, por tanto, tenían una fiabilidad limitada. El presente estudio viene a confirmar la seguridad de este dispositivo en pacientes con alto riesgo de sangrado.
¿Cómo podemos considerar los resultados de este estudio?
Además del grosor del strut del stent convencional utilizado en el LEADERS FREE, la tasa de eventos registrada fue motivo de controversia. El estudio Onyx ONE partió de idénticos criterios de inclusión y, en consecuencia, los pacientes fueron muy similares. En este caso se encuentra una tasa de mortalidad por causa cardiaca similar, en torno al 4%, y una tasa global de trombosis del stent ligeramente inferior al 2%, pero una tasa de infarto de miocardio que duplica la encontrada en el estudio LEADERS FREE, hecho que llama la atención, pues el criterio utilizado fue similar en ambos estudios: la tercera definición universal del infarto de miocardio12. Sin duda, hay que esperar a la publicación del estudio para saber si esto se explica por diferencias en el riesgo basal de los pacientes o por otros motivos. En cualquier caso, la mayor tasa de eventos, tanto en el objetivo primario como en sus componentes por separado, en comparación con la mayoría de los estudios realizados con las generaciones actuales de stents, hay que buscarla sin ninguna duda en el alto riesgo de los pacientes incluidos; claramente, tanto por la edad como por el porcentaje de diabetes, los antecedentes de sangrado y la anticoagulación oral, se trata de un perfil de más riesgo.
¿Se puede considerar que hay un efecto de clase de todos los stents farmacoactivos en estos pacientes?
Existen varios stents con marcado CE para pautas cortas de TAPD, incluso de 1 mes. Sin embargo, debemos recordar que el marcado CE no es una indicación, sino un uso on label bajo determinadas circunstancias, y esta recomendación siempre viene acompañada del mensaje de que se deben seguir las pautas recomendadas en las guías, y además una interrupción precoz es responsabilidad del médico que trate al paciente tomando en consideración sus condiciones particulares.
El presente estudio muestra los resultados de estos 2 stents en concreto en pacientes con alto riesgo de sangrado. Se han realizado otros 3 estudios con pautas de TAPD de 1 mes centrados en un determinado modelo de stent: el SENIOR7, el STOPDAPT-26 y el GLOBAL LEADERS5. Otros estudios, como el SMART-CHOICE13 y el recientemente publicado TWILIGHT4, han evaluado pautas de 3 meses de TAPD y han incluido pacientes con diferentes stents, por lo que tienen diseños diferentes al del Onyx ONE.
En el estudio SENIOR7 se aleatorizó a 1.200 pacientes de 75 años o más de edad para el implante de stent convencional o de stent SYNERGY (Boston Scientific, Estados Unidos), con pauta de 1 mes de TAPD en los pacientes estables y de 6 meses en los que presentaban SCA. En el 88% de los casos se usó clopidogrel durante el tiempo de TAPD. Los resultados fueron favorables al stent farmacoactivo, con una tasa de eventos del 12% frente al 16% en el objetivo primario de muerte de cualquier causa, infarto, accidente cerebrovascular o revascularización de la lesión tratada, y con similar tasa de sangrado (5%) y de trombosis del stent (1%). Este estudio, si bien sirvió para proporcionar datos de eficacia y seguridad del stent SYNERGY en ancianos, seguía una pauta de 6 meses en el SCA que corresponde aproximadamente al 45% de los pacientes incluidos. Por otra parte, pese a ser pacientes de mayor edad que los del Onyx ONE, el porcentaje de diabéticos y con fibrilación auricular era sensiblemente más bajo. Por todo ello, aunque este estudio aporta datos favorables sobre el comportamiento del SYNERGY en ancianos, hay que tener en cuenta que no se trata del mismo tipo de pacientes ni de la misma pauta.
En el estudio STOPDAPT-26 se comparó, en 3.045 pacientes tratados con stents de cromo-cobalto Xience (Abbott Vascular, Estados Unidos), una pauta estándar de 12 meses de TAPD con AAS y clopidogrel, a partir de los cuales se suspendía el clopidogrel, con otra pauta de 1 mes de TAPD, a partir del cual se suspendía el AAS y se continuaba con clopidogrel hasta los 5 años. En el primer mes se permitió el prasugrel, pero a partir de ese momento el inhibidor de P2Y12 fue siempre clopidogrel. El objetivo primario de no inferioridad se alcanzó, pero de nuevo la población era de riesgo muy inferior al de la población del Onyx ONE, pues la edad media era de 68,6 años, solo un 38% presentaba SCA, menos de un 1% recibía anticoagulación oral y, sobre todo, había un 90% con riesgo trombótico y de sangrado bajo o intermedio según las escalas CREDO-Kyoto y PARIS. De nuevo, aunque es un estudio importante que aporta datos muy favorables para el stent Xience, no se trata del mismo perfil de riesgo de pacientes.
Finalmente, en el estudio GLOBAL LEADERS5 se comparó, en 15.968 pacientes, una pauta de TAPD de 1 mes con ticagrelor y AAS, seguida de 24 meses con ticagrelor, con otra estándar de 12 meses de TAPD con AAS y clopidogrel en los pacientes con angina estable o ticagrelor en los pacientes con SCA, seguida de otros 12 meses solo con AAS, siendo todos los pacientes tratados con el stent de biolimus A9. En este estudio, la pauta de intervención no fue superior a la estándar, pues aunque los resultados fueron favorables en el primer año, el exceso de sangrados durante el segundo año motivó que el objetivo primario del estudio, a 2 años, fuese negativo. Por otra parte, nuevamente el perfil de riesgo de los pacientes era más bajo que en el Onyx ONE: su edad era mucho menor, había un menor porcentaje de diabéticos, la tasa de antecedentes de sangrado era inferior al 1% y se excluyeron los pacientes con anticoagulación oral.
COMENTARIOS FINALES
Aunque aún hay que esperar a la publicación del estudio, puede decirse que el Onyx ONE tiene especial importancia por 2 razones. La primera, porque demuestra que el stent Resolute Onyx obtiene los mismos resultados clínicos, e incluso superiores en términos de éxito del dispositivo, que el de referencia hasta el momento actual en pacientes con alto riesgo de sangrado, que era el BioFreedom, y por ello a partir de ahora ya se dispone de 2 opciones muy válidas en este contexto. La segunda razón se centra en los pacientes con SCA. La mitad de los pacientes incluidos tenía cardiopatía isquémica estable, para la que las guías recomiendan TAPD durante 1 mes14. Es precisamente en los pacientes con SCA en los que este estudio tiene más importancia, pues supone desviarse totalmente de la pauta recomendada en las guías, que indican TAPD entre 6 y 12 meses según la escala PRECISE-DAPT14. El estudio es de gran relevancia por tratarse de pacientes con alto riesgo de sangrado, en los que esta complicación puede tener más importancia que el riesgo isquémico. Hay que recordar que la recomendación de 12 meses en pacientes con SCA proviene del estudio CURE15, en el cual, pese a incluir 12.562 pacientes, no se encontraron diferencias significativas en cuanto a muerte e ictus (2 de los 3 eventos adversos mayores que formaban el objetivo primario), y el estudio resultó positivo por la disminución de la tasa de infarto no fatal. También cabe comentar que la información sobre los pacientes con SCA del estudio Onyx ONE aún es limitada, pues solo se dispone de datos del estudio global y, si bien en el LEADERS FREE este subgrupo se benefició del uso del stent farmacoactivo en comparación con su homólogo convencional16, todavía no se conocen los datos comparativos de ambos stents en pacientes con SCA.
Por último, en este estudio, la pauta corta de TAPD engloba 2 estrategias. Una, el acortamiento de la terapia en relación con lo recomendado en las guías, 6-12 meses en el SCA. La otra, la eliminación del AAS en la mitad de los casos como antiagregante único desde el segundo hasta el duodécimo mes. Si bien la estrategia de eliminar el AAS desde el primer o el tercer mes cada vez está siendo más estudiada4-6,13, también habrá que esperar a la publicación del estudio para saber si existe interacción en este importante aspecto.
CONFLICTO DE INTERESES
No se declara ninguno.
BIBLIOGRAFÍA
1. Camenzind E, Steg PG, Wijns W. Stent thrombosis late after implantation of first-generation drug-eluting stents:a cause for concern. Circulation. 2007;115:1440-1455;discussion 1455.
2. Feres F, Costa RA, Abizaid A, et al. Three vs twelve months of dual antiplatelet therapy after zotarolimus-eluting stents:the OPTIMIZE randomized trial. JAMA. 2013;310:2510-2522.
3. Kim BK, Hong MK, Shin DH, et al. A new strategy for discontinuation of dual antiplatelet therapy:the RESET Trial (REal Safety and Efficacy of 3-month dual antiplatelet Therapy following Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol. 2012;60:1340-1348.
4. Mehran R, Baber U, Sharma SK, et al. Ticagrelor with or without Aspirin in High-Risk Patients after PCI. N Engl J Med. 2019;381:2032-2042.
5. Vranckx P, Valgimigli M, Juni P, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent:a multicentre, open-label, randomised superiority trial. Lancet. 2018;392:940-949.
6. Watanabe H, Domei T, Morimoto T, et al. Effect of 1-Month Dual Antiplatelet Therapy Followed by Clopidogrel vs 12-Month Dual Antiplatelet Therapy on Cardiovascular and Bleeding Events in Patients Receiving PCI:The STOPDAPT-2 Randomized Clinical Trial. JAMA. 2019;321:2414-2427.
7. Varenne O, Cook S, Sideris G, et al. Drug-eluting stents in elderly patients with coronary artery disease (SENIOR):a randomised single-blind trial. Lancet. 2018;391:41-50.
8. Morice MC, Urban P, Greene S, Schuler G, Chevalier B. Why are we still using coronary bare-metal stents?J Am Coll Cardiol. 2013;61:1122-1123.
9. Urban P, Meredith IT, Abizaid A, et al. Polymer-free Drug-Coated Coronary Stents in Patients at High Bleeding Risk. N Engl J Med. 2015;373:2038-2047.
10. Silber S, Kirtane AJ, Belardi JA, et al. Lack of association between dual antiplatelet therapy use and stent thrombosis between 1 and 12 months following resolute zotarolimus-eluting stent implantation. Eur Heart J. 2014;35:1949-1956.
11. Valgimigli M, Patialiakas A, Thury A, et al. Zotarolimus-eluting versus bare-metal stents in uncertain drug-eluting stent candidates. J Am Coll Cardiol. 2015;65:805-815.
12. Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. J Am Coll Cardiol. 2012;60:1581-1598.
13. Hahn JY, Song YB, Oh JH, et al. Effect of P2Y12 Inhibitor Monotherapy vs Dual Antiplatelet Therapy on Cardiovascular Events in Patients Undergoing Percutaneous Coronary Intervention:The SMART-CHOICE Randomized Clinical Trial. JAMA. 2019;321:2428-2437.
14. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS:The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213-260.
15. Yusuf S, Zhao F, Mehta SR, et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345:494-502.
16. Naber CK, Urban P, Ong PJ, et al. Biolimus-A9 polymer-free coated stent in high bleeding risk patients with acute coronary syndrome:a LEADERS FREE ACS sub-study. Eur Heart J. 2017;38:961-969.
Autor para correspondencia: Servicio de Cardiología, Hospital de Cabueñes, Avda. Los Prados 395, Gijón 33203, España.
Correo electrónico: inigo.lozano@gmail.com (Í. Lozano)
RESUMEN
La angioplastia primaria está reconocida como la mejor estrategia de reperfusión en el infarto de miocardio con elevación del segmento ST. No obstante, la mejor estrategia para el tratamiento de las lesiones coronarias significativas en arterias no relacionadas con el infarto no se había estudiado convenientemente. Hasta la fecha se habían realizado varios estudios aleatorizados pero con objetivos de beneficio clínico de gravedad menor o «blandos» y pocos pacientes. Por primera vez, el estudio COMPLETE proporciona evidencia científica sólida sobre la estrategia terapéutica en pacientes con infarto de miocardio con elevación del segmento ST y enfermedad multivaso. Este estudio, que incluyó a más de 4.000 pacientes, ha demostrado que la revascularización completa reduce significativamente el riesgo combinado de mortalidad o infarto de miocardio.
Palabras clave: IAMCEST. Revascularización coronaria percutánea. Estudio COMPLETE.
ABSTRACT
Primary angioplasty is now clearly established as the best reperfusion strategy for patients with ST-segment elevation myocardial infarction (STEMI), but the best strategy for significant stenosis at non-culprit vessels has not been adequately studied. Several randomized trials have been previously performed, but all of them with soft primary endpoints and consequently a low number of patients. The COMPLETE trial, for the first time, provides us with solid scientific evidence about what we should do in patients with STEMI and multi-vessel disease. This study included more than 4000 patients and has shown that complete revascularization reduces significantly the risk of cardiovascular death or myocardial infarction.
Keywords: STEMI. Percutaneous coronary revascularization. COMPLETE trial.
Abreviaturas: IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
Los sólidos resultados del estudio COMPLETE1 publicado recientemente demuestran claramente que la revascularización de lesiones no culpables después de una angioplastia primaria en el tratamiento del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) mejora los resultados a largo plazo. Algo que ahora ha quedado claro y probablemente se acepte como una estrategia general; uno de los últimos pasos de un largo viaje (figura 1). Todo empezó hace mucho, cuando el tratamiento de los infartos agudos de miocardio, cada vez mejor y más agresivo, consiguió mejorar el pronóstico a corto y largo plazo reduciendo los índices de mortalidad a niveles inimaginables hace tan solo unos años. Érase una vez que, basándose en hallazgos anatomopatológicos, se pensaba equivocadamente que las oclusiones coronarias durante un infarto agudo de miocardio se debían a la necrosis miocárdica y no al revés. Habría que esperar a la década de 1980 para que se confirmara que abrir la coronaria culpable obstruida mejoraba los resultados. Revascularizar lo antes posible también era importante, obviamente todo ello acompañado de un mejor tratamiento médico, una reorganización de la estrategia y una mucho mejor prevención secundaria inmediatamente después de sufrir un episodio agudo2-4.
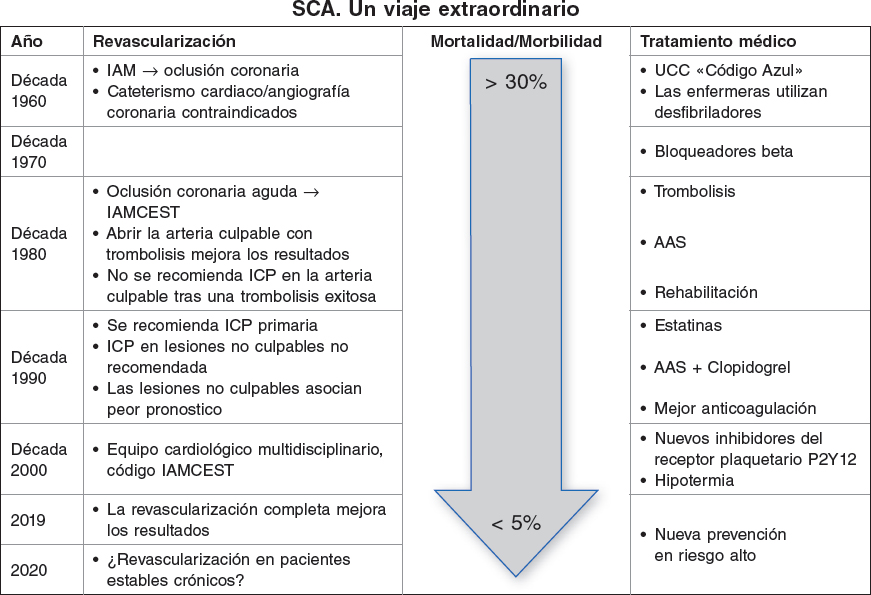
Figura 1. Evolución de la revascularización, tratamientos médicos y resultados en el tratamiento del IAMCEST. AAS: ácido acetilsalicílico; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; UCC: unidad de cuidados coronarios.
Hasta la fecha, todos los avances en revascularización han girado en torno al vaso culpable (una exitosa y duradera recanalización inmediata del mismo), aunque los intentos que se han hecho sobre vasos enfermos no culpables han arrojado resultados dudosos.
El estudio COMPLETE comparó una estrategia de revascularización solo del vaso culpable con la revascularización completa en pacientes IAMCEST con otras estenosis coronarias significativas identificadas durante la realización de la angioplastia primaria. El estudio incluyó a 4.041 pacientes durante un seguimiento mediano de 3 años. Se observaron incidencias significativamente menores para el primer objetivo coprimario de muerte cardiovascular o infarto de miocardio y para el segundo objetivo coprimario de muerte cardiovascular, infarto de miocardio o revascularización motivada por la isquemia en el grupo que recibió revascularización completa comparado con aquel en el que solo se revascularizó la arteria culpable. Este beneficio favorable a la revascularización completa se observó poco después de la inclusión en el estudio y se hizo más evidente durante el seguimiento a 3 años (figura 2). Estas observaciones coinciden en los distintos subgrupos. Hubo un aumento pequeño y no significativo de las hemorragias mayores y el fracaso renal agudo inducido por contraste. El beneficio se vio condicionado principalmente por un significativo descenso del infarto de miocardio y la revascularización motivada por la isquemia.
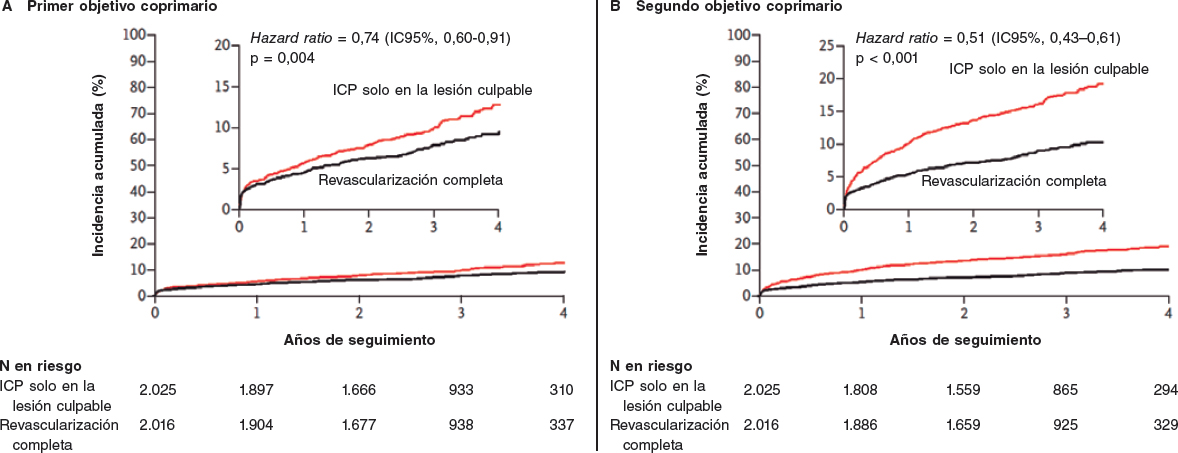
Figura 2. Principales resultados del estudio COMPLETE. Curvas de Kaplan-Meier para el primer (muerte por causas cardiovasculares o nuevo infarto de miocardio) y segundo objetivos coprimarios (muerte por causas cardiovasculares, nuevo infarto de miocardio o revascularización motivada por la isquemia). IC: intervalo de confianza; ICP: intervención coronaria percutánea. Reproducido de Mehta et al.1 con permiso.
Estudios previos con objetivos de beneficio más blandos no demostraron que la revascularización completa fuera beneficiosa en la muerte o en el infarto de miocardio, aunque es cierto que el número de pacientes de estos estudios era muy pequeño5-10, de los 69 pacientes del HELP-AMI6 hasta los 885 del COMPARE-ACUTE8, ambos representativos de una pequeña fracción del número de pacientes incluidos en el COMPLETE.
Como la mayoría de los estudios, el COMPLETE plantea algunas cuestiones prácticas. En primer lugar, ¿es este beneficio clínicamente significativo? El estudio arroja resultados sólidos, pero no confirma descensos de la mortalidad cardiovascular, la insuficiencia cardiaca y la mortalidad por cualquier causa. Se acepta que la enfermedad multivaso es un factor de riesgo claro de mortalidad tras un IAMCEST11; no obstante, los criterios de inclusión y sobre todo de exclusión del estudio COMPLETE seleccionaron a un grupo de pacientes de bajo riesgo. La tasa de mortalidad cardiovascular fue solo del 1% anual y es casi imposible demostrar un descenso de la mortalidad en esta población. Sin embargo, sí se observó un descenso significativo del infarto de miocardio (del 2,8 al 1,9% anual), la angina inestable (del 2,2 al 1,2% anual) y la revascularización motivada por la isquemia (del 2,8 al 0,5% anual) sin más complicaciones mayores. Todo esto servirá para convencer a cardiólogos intervencionistas y clínicos a que tengan muy en cuenta esta estrategia. Es evidente que se siguió la recomendación de las guías de práctica clínica sobre prevención secundaria, pero este es un campo que avanza con rapidez12, complementando las estrategias de revascularización y minimizando el papel relativo que tiene cada componente.
En segundo lugar, ¿la revascularización debe ser completa en todos los pacientes? La respuesta es sí en todos los casos que cumplen los criterios de inclusión y no los de exclusión del estudio COMPLETE (tabla 1), pero no en pacientes con enfermedad de pequeños vasos, estenosis coronaria epicárdica no significativa, antecedentes de cirugía de derivación coronaria y otros. No debemos olvidar que el estudio COMPLETE excluyó a pacientes en shock cardiogénico, pacientes en quienes se ha confirmado que la revascularización completa rutinaria es perjudicial13. Si todos los pacientes que cumplen los criterios del estudio COMPLETE deben someterse a revascularización completa ya es más difícil de responder. Identificar a los pacientes de mayor riesgo según sus características clínicas y proporcionar información adicional sobre su anatomía coronaria y en particular sobre la estabilidad de la placa, permitiría seleccionar a la población de pacientes que más se beneficiaría. Probablemente pueda extraerse esta información de la base de datos del estudio.
Tabla 1. Elegibilidad de los pacientes del estudio COMPLETE. Principales criterios de inclusión y exclusión
| Criterios de inclusión |
|---|
| IAMCEST |
| Éxito de la ICP en la lesión culpable |
| Al menos 1 lesión no culpable |
| Diámetro de la lesión no culpable ≥ 2,5 mm |
| Estenosis de la lesión no culpable > 70% o |
| 50–60% de estenosis y RFF ≤ 0,8 |
| Revascularización inmediata y nunca 72 h después de la ICP índice |
| Criterios de exclusión |
| Revascularización quirúrgica programada |
| Antecedentes de cirugía de derivación coronaria |
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; RFF: reserva fraccional del flujo. |
En tercer lugar, una cuestión clave está relacionada con la cronología de la revascularización completa. El estudio COMPLETE recomendó una revascularización en etapas y no un único procedimiento. No obstante, algunos estudios han evaluado la revascularización completa en un único procedimiento en pacientes con IAMCEST y con enfermedad multivaso con buenos datos de seguridad y de eficacia7,10. La revascularización completa en un único procedimiento redujo los eventos cardiovasculares en comparación con la revascularización en etapas en pacientes con IAMSEST14. En la actualidad, el estudio The BioVasc (NCT03621501) está realizando una comparativa entre el procedimiento único y en etapas en pacientes tanto IAMCEST como IAMSEST. Según el estudio COMPLETE, la revascularización completa debe realizarse durante la hospitalización inicial, aunque no ofrece datos sobre la revascularización en un único procedimiento.
Por último, se plantea la cuestión ¿puede la revascularización mejorar los resultados de la cardiopatía isquémica estable? Esto está fuera del ámbito de actuación del COMPLETE, y hasta la fecha existe una base de evidencia muy débil al respecto, en el mejor de los casos se ha observado solo un beneficio marginal para la revascularización15. El estudio ISCHEMIA16, actualmente en fase de seguimiento, compara el beneficio de revascularización más tratamiento médico frente a solo tratamiento médico en más de 5.000 pacientes y sus resultados se publicarán muy pronto. No cabe duda de que los resultados serán clave para mejorar la estrategia del tratamiento invasivo de la cardiopatía isquémica estable. ¿Será beneficiosa la revascularización completa en pacientes con síndromes coronarios agudos sin elevación del segmento ST? Es probable, aunque no lo sabemos ni se han realizado estudios sobre esta cuestión.
Mientras tanto, no lo dude, hay que considerar que los pacientes IAMCEST tratados con una angioplastia primaria son buenos candidatos a recibir revascularización completa dentro de las 72 horas anteriores al alta hospitalaria.
CONFLICTO DE INTERESES
J. López-Sendón ha recibido subvenciones de McMaster University (Hamilton, Ontario, Canadá) durante la realización del estudio. J. López-Sendón y R. Moreno son coautores del artículo al que hace referencia este trabajo. R. Moreno es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
BIBLIOGRAFÍA
1. Mehta SR, Wood, DA. Storey RF, et al.;for the COMPLETE Trial Steering Committee and Investigators. Complete revascularization with multivessel PCI for myocardial Infarction. N Engl J Med. 2019. https://www.nejm.org/doi/10.1056/NEJMoa1907775.
2. González-Juanatey JR, Agra Bermejo R, López-Sendón J. Una historia resumida. Impacto de los avances en cardiopatía isquémica. Rev Esp Cardiol. 2017;17(Suppl A):2-6.
3. Ibañez B, James S, Agewall S, et al.;, for the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018:39:119-177.
4. Neumann FJ, Sousa-Uva M, Ahlsson A, et al.;for the The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and European Association for Cardio-Thoracic Surgery (EACTS) 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
5. Moreno R, Mehta SR. Nonculprit Vessel Intervention:Let's COMPLETE the Evidence. Rev Esp Cardiol. 2017;70:418–420.
6. Di Mario C, Sansa M, Airoldi F, et al. Single vs multivessel treatment during primary angioplasty:results of the multicenter randomized HEpacoat for cuLPrit or multi vessel stenting for Acute Myocardial Infarction (HELP-AMI) study. Int J Cardiovasc Intervent. 2004;6:128-133.
7. ald DS, Morris JK, Wald NJ, et al. PRAMI Investigators. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med. 2013;369: 1115-1123.
8. Engstrøm T, Kelbæk H, Helqvist S, et al.;for the DANAMI-3—PRIMULTI Investigators. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI):an open-label, randomised controlled trial. Lancet. 2015;386:665-671.
9. Smits PC, Abdel-Wahab M, et al. for the Compare-Acute Investigators. Fractional Flow Reserve–Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med. 2017;376:1234-1244.
10. Politi L, Sgura F, Rossi R, et al. A randomised trial of target-vessel versus multi-vessel revascularisation in ST-elevation myocardial infarction:Major adverse cardiac events during long-term follow-up. Heart. 2010;96:662-667.
11. Moreno R, García E, Elízaga J, et al. Results of primary angioplasty in patients with multivessel disease. Rev Esp Cardiol. 1998;51:547-555.
12. Knuuti J, Wijns W, SarasteA, et al.;for the Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes:The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2019. https://doi.org/10.1093/eurheartj/ehz425.
13. Thiele H, Akin I, Sandri M, et al.;CULPRIT-SHOCK Investigators. PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med. 2017;377:2419-2432.
14. Sardella G, Lucisano L, Garbo R, et al. Single-staged compared with multi-staged PCI in multivessel NSTEMI patients:the SMILE trial. J Am Coll Cardiol. 2016;67:264-272.
15. Stergiuopoulos K, Boden WE, Hartinhan P, et al. Percutaneous Coronary Intervention Outcomes in Patients With Stable Obstructive Coronary Artery Disease and Myocardial IschemiaA Collaborative Meta-analysis of Contemporary Randomized Clinical Trials. JAMA Intern Med. 2014;174:232-240.
16. Hochman JS, Reynolds HR, Bangalore S, et al.;for the ISCHEMIA Research Group. Baseline characteristics and risk profiles of participants in the ISCHEMIA randomized clinical trial. JAMA Cardiol. 2019;4:273-286
Corresponding author: Servicio de Cardiología, Hospital Universitario La Paz, P.º de la Castellana 261, 28046 Madrid, España.
Correo electrónico: jlopezsendon@gmail.com (J. López-Sendón).

