RESUMEN
Introducción y objetivos: El dispositivo Lotus (Boston Scientific, Estados Unidos) es una prótesis valvular aórtica transcatéter de segunda generación, completamente recuperable y reposicionable. Se presenta la experiencia inicial con la prótesis Lotus en un registro multicéntrico.
Métodos: Estudio observacional que reporta los resultados a corto y largo plazo del implante transfemoral de prótesis Lotus entre marzo de 2014 y abril de 2016 en 8 centros de España y Portugal.
Resultados: Se incluyeron 102 pacientes (edad media 80,4 ± 6,1 años, índice STS medio 5,2% ± 3,3%) con estenosis aórtica grave sintomática (área valvular media 0,66 ± 0,17 cm2, gradientes 74,3/45,6 mmHg). Se implantó con éxito el dispositivo en 100 pacientes (98%), con mejoría significativa de los gradientes máximo y medio valvular, y un solo caso de regurgitación periprotésica moderada. No hubo ninguna embolización ni necesidad de implante de una nueva prótesis intravalvular. Hasta el alta hospitalaria, la mortalidad fue del 3,9% y la tasa de ictus fue del 2,9%. En 33 pacientes (32,3%) fue necesario el implante de marcapasos definitivo.
Conclusiones: La válvula Lotus es eficaz y segura para el tratamiento de pacientes con estenosis aórtica grave sintomática. Destacan la escasa tasa de insuficiencia periprotésica y la ausencia de complicaciones derivadas del mal posicionamiento o la embolización de la prótesis, a costa de un alta incidencia de implante de marcapasos.
Palabras clave: Prótesis aórtica transcatéter. Estenosis aórtica.
ABSTRACT
Introduction and objectives: The Lotus Valve device (Boston Scientific) is a second-generation fully-retrievable and repositionable transcatheter aortic valve. We report the initial multicenter experience with the Lotus valve in the management of patients with severe aortic stenosis.
Methods: Observational study that described the short and long-term results of implanting the Lotus valve in 8 Spanish and Portuguese centers from March 2014 through April 2016.
Results: The study included 102 patients (mean age 80.4 ± 6.1 years; STS score 5.2% ± 3.3%) with severe symptomatic aortic stenosis (mean aortic valve area 0.66 ± 0.17 cm2, aortic gradients 74.3 / 45.6 mmHg). The valve was successfully implanted in 100 patients (98%), with significant improvement in both the peak and mean aortic valve gradients and with only one patient showing moderate paravalvular regurgitation. Upon hospital discharge, mortality rate was 3.9% while the stroke rate was 2.9%. No cases of valve embolization, ectopic valve deployment or additional valve implantation (valve-in-valve) were seen. Thirty-three patients (32.3%) received a permanent pacemaker.
Conclusions: The Lotus Valve System is effective and safe for the management of patients with severe symptomatic aortic stenosis. In particular, considering the low rate of periprosthetic regurgitation and lack of complications like embolization or ectopic valve deployment; however at the expense of a high pacemaker implantation rate.
Keywords: Transcatheter aortic Valve. Aortic stenosis.
Abreviaturas: EAo: estenosis aórtica. IAo: insuficiencia aórtica. TAVI: implante percutáneo de válvula aórtica.
INTRODUCCIÓN
El implante percutáneo de válvula aórtica (TAVI, transcatheter aortic valve implantation) es una opción terapéutica en pacientes con estenosis aórtica (EAo) grave sintomática, que ha demostrado ser por lo menos no inferior al recambio valvular aórtico quirúrgico incluso en pacientes de bajo riesgo1-8.
Sin embargo, persisten complicaciones asociadas a los TAVI que pueden tener un impacto negativo sobre los resultados a corto y medio-largo plazo, y entre ellas destaca la insuficiencia aórtica (IAo) periprotésica, que se ha asociado a un aumento de la mortalidad intrahospitalaria y a medio y largo plazo tras el TAVI9-12. Varios factores se han relacionado con el desarrollo de insuficiencia periprotésica, como una infraexpansión de la prótesis secundaria a una calcificación grave del anillo aórtico o un mal posicionamiento del dispositivo, factor este último que se asocia también a otras complicaciones, como la embolización de la prótesis. Con el fin de reducir estos percances se han desarrollado dispositivos de segunda generación, en parte o totalmente reposicionables, con diseños innovadores.
El dispositivo Lotus (Boston Scientific, Estados Unidos) es una válvula aórtica transcatéter de segunda generación, completamente recuperable y reposicionable, cuyo diseño tiene como objeto principal minimizar el riesgo de complicaciones relacionadas con una mala posición de la prótesis, en particular la IAo periprotésica y la embolización del dispositivo13.
El objetivo de este estudio es presentar la experiencia inicial en España y Portugal en el tratamiento de la EAo con la prótesis Lotus.
MÉTODOS
Selección de pacientes
Estudio observacional en el que se incluyeron todos los pacientes consecutivos con EAo grave sometidos a implante transfemoral de prótesis Lotus entre marzo de 2014 y abril de 2016 en centros de España y Portugal que ofrecieron voluntariamente sus datos. Todos los pacientes tenían EAo grave (área valvular aórtica < 1 cm2) sintomática o con disfunción ventricular izquierda, según las recomendaciones de la guía de valvulopatías de la Sociedad Europea de Cardiología14; la indicación, en cualquier caso, se estableció de acuerdo con los protocolos locales de cada centro, tras ser evaluado el caso por un equipo multidisciplinario. Para la valoración del riesgo quirúrgico se utilizó la escala de riesgo STS15, pero su valor no fue un criterio de inclusión o de exclusión en el registro puesto que en la selección de los pacientes también se tuvieron en cuenta aspectos clínicos y anatómicos no presentes en las escalas de riesgo quirúrgico (aorta en porcelana, puente de mamaria permeable, tórax hostil, etc.).
Variables del estudio
Se recogieron las variables clínicas y ecocardiográficas basales principales de los pacientes, los detalles del procedimiento y los resultados clínicos y ecocardiográficos hasta el alta hospitalaria, con particular atención a las complicaciones durante y después del procedimiento. La recogida de los datos fue prospectiva en cada centro, aunque no hubo un protocolo común para ello ni para la asignación de resultados clínicos y ecocardiográficos. Cada centro ofreció su propia base de datos, y todas se unificaron en una única base común.
La evaluación clínica y las pruebas diagnósticas previas al implante fueron similares a las de las recomendaciones habituales14. Algunas variables no se recogieron de forma sistemática en todos los centros y, por tanto, no se incluyeron en el análisis final del estudio.
En cuanto a los datos del procedimiento, las variables principales estudiadas fueron la realización o no de valvuloplastia previa, la recaptura total o parcial del dispositivo, la necesidad de posdilatación, el grado de insuficiencia valvular y los gradientes transvalvulares después del procedimiento. Se compararon finalmente tanto los gradientes medio y máximo como la prevalencia de IAo moderada previa y posterior al implante del dispositivo.
Para la recogida de las complicaciones relacionadas con el procedimiento se siguieron las recomendaciones del documento de consenso Valve Academic Research Consortium 216. Se analizaron la siguientes complicaciones: mortalidad, accidentes cerebrovasculares, complicaciones hemorrágicas, complicaciones vasculares mayores y menores, implante de marcapasos definitivos e insuficiencia renal, además de datos ecocardiográficos indicativos de disfunción protésica (gradiente protésico medio > 20 mmHg, área valvular efectiva < 0,9-1,1 cm2, índice de velocidad Doppler < 0,35 y IAo moderada o grave). Como parámetro combinado de eficacia se consideró la siguiente definición según los criterios del Valve Academic Research Consortium 2: implante adecuado de una sola prótesis + ausencia de mortalidad intrahospitalaria + ausencia de gradiente medio > 20 mmHg, área valvular aórtica ≥ 1,2 cm2, índice de velocidad Doppler < 0,35 o IAo moderada o grave. Como parámetro combinado de seguridad inicial (hasta el alta hospitalaria) se consideró la siguiente definición: ausencia de mortalidad por cualquier causa, ictus, sangrado peligroso para la vida, fracaso renal de grado 2-3, obstrucción coronaria con necesidad de intervención, complicación vascular mayor o disfunción protésica con necesidad de nueva intervención.
Finalmente, se realizó de forma retrospectiva un seguimiento de los pacientes a los 3 años de haber terminado la inclusión en el registro, recogiendo parámetros tanto clínicos (mortalidad y eventos cardiovasculares) como ecocardiográficos.
La compañía Boston Scientific no ha desempeñado ningún papel en el diseño ni en el desarrollo del estudio.
Descripción del dispositivo
El dispositivo Lotus que se utilizó en el registro es una válvula de pericardio bovino (3 valvas) incorporada en una endoprótesis de nitinol, precargada y que se despliega mediante un sistema de expansión mecánica controlada. Antes de comenzar a expandirse mide 72 mm y, una vez implantada, 19 mm. Se comercializa en 3 diámetros: 23, 25 y 27 mm. En la actualidad, el dispositivo que se encuentra en el mercado es el LOTUS Edge, que tiene un catéter de liberación más flexible y un sistema de implantación más sencillo, y que puede implantarse a través de un introductor expandible de 14 Fr.
El sistema de colocación y la vaina de introducción están diseñados para facilitar una colocación predecible y precisa, que asegura la funcionalidad temprana de la válvula, así como la posibilidad de su recolocación o retirada no traumáticas en cualquier momento antes de la liberación definitiva del implante valvular. El dispositivo cuenta también con un sistema de sellado (membrana de uretano) diseñado para minimizar la incidencia de regurgitación paravalvular.
Procedimiento
El implante se llevó a cabo siguiendo el método ya descrito en la literatura13. Resumiendo, se realizó en el laboratorio de hemodinámica bajo anestesia general o con sedación profunda, en ambiente estéril y, según las preferencias del operador, guiado o no mediante ecocardiografía transesofágica.
Se utilizó el acceso transfemoral en todos los casos, mediante técnica completamente percutánea o por exposición quirúrgica. Se avanzó un introductor de 18 Fr para la prótesis de 23 mm (diámetro mínimo requerido: 6 mm) y de 20 Fr para las de 25 y 27 mm (diámetro mínimo requerido: 6,5 mm), hasta la aorta descendente, y se cruzó la válvula aórtica nativa mediante la técnica habitual. Antes de cruzar con la guía al ventrículo izquierdo, se implantó un marcapasos venoso transitorio.
Se utilizó como guía de alto soporte la guía Safari (0,035 in, 260 cm) (Boston Scientific). La decisión de realizar o no valvuloplastia previa con balón dependió de los criterios del operador.
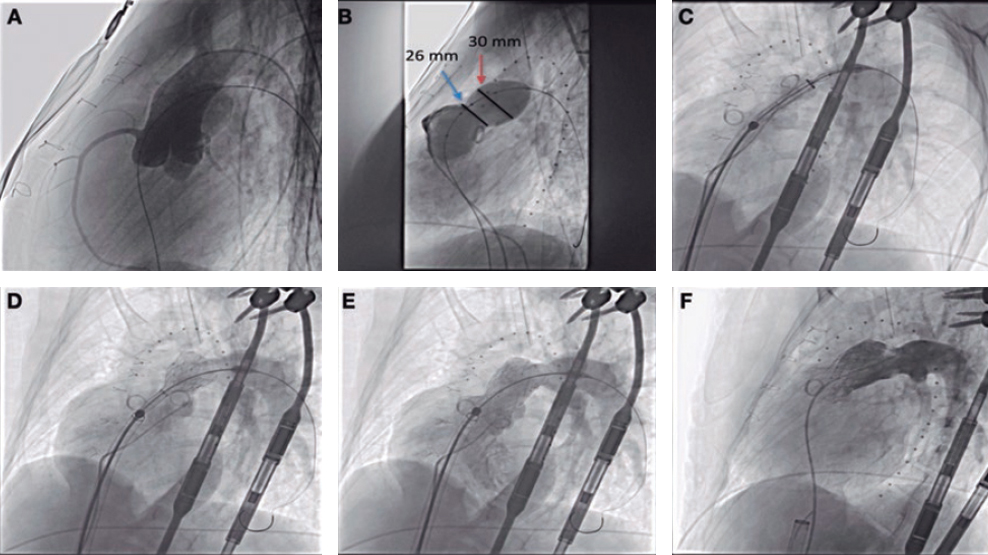
Para la implantación del dispositivo, se dirige el sistema de liberación posicionando el marcador radioopaco hacia la parte externa de la aorta, para facilitar el avance del catéter de acuerdo con la morfología adaptada de este. Una vez cruzada la válvula aórtica nativa, y sin necesidad de sobreestimulación, se expande la prótesis, se comprueban el correcto enganche de los sistemas que soportan las valvas y el adecuado posicionamiento del dispositivo, y se procede entonces a su liberación y la retirada del sistema (figura 1).
Figura 1. Procedimiento de implante de la prótesis Lotus.
En ausencia de trastornos importantes de la conducción auriculoventricular, el marcapasos transitorio se retiró a las 24-48 horas del procedimiento. Las indicaciones de marcapasos definitivo fueron las establecidas por los protocolos locales de cada centro. El tratamiento antitrombótico al alta fue doble antiagregación con ácido acetilsalicílico y clopidogrel durante los primeros 3-6 meses, excepto en los casos con indicaciones para la anticoagulación oral crónica.
Análisis estadístico
El análisis estadístico se realizó con el programa SPSS 22 (SPSS Inc., Estados Unidos). Las variables categóricas se expresaron como proporciones, y las cuantitativas como media ± desviación estándar o mediana (intervalo intercuartílico). La comparación de las variables continuas se realizó mediante la prueba t de Student para datos apareados, y las de variables categóricas con la prueba χ2.
RESULTADOS
Características basales de los pacientes
Se incluyeron 102 pacientes (5 centros españoles y 3 centros portugueses) (tabla 1). Las características basales recogidas se muestran en tabla 2. La edad media fue de 80,4 ± 6,1 años, el 52,9% eran mujeres y el índice STS fue del 5,4% (3,7-7,7).
Tabla 1. Hospitales participantes en el estudio y número de pacientes por hospital
| Hospital Universitario La Paz, Madrid, España | 33 (32,4%) |
| Policlínica Gipuzkoa, San Sebastián, España | 19 (18,6%) |
| Hospital Universitari Vall d’Hebron, Barcelona, España | 7 (6,9%) |
| Hospital Virgen de las Nieves, Granada, España | 8 (7,8%) |
| Hospital Puerta del Mar, Cádiz, España | 6 (5,9%) |
| Centro Hospitalar de Vila Nova de Gaia, Oporto, Portugal | 8 (7,8%) |
| Centro Hospitalar de Lisboa Central, Lisboa, Portugal | 10 (9,8%) |
| Hospital Santa Cruz, Lisboa, Portugal | 11 (10,8%) |
Tabla 2. Características basales de los pacientes (N = 102)
| Edad (años) | 80,4 ± 6,1 |
| Sexo femenino | 54 (52,9%) |
| Enfermedad coronaria | 44 (43,1%) |
| Revascularización percutánea | 24 (54,5%) |
| Revascularización quirúrgica | 11 (25%) |
| Sin revascularizar | 9 (20,5%) |
| Enfermedad cerebrovascular antes del TAVI | 8 (7,8%) |
| Insuficiencia renal crónica (ACr < 60 ml/min) | 37 (36,3%) |
| Sin diálisis | 33 (32,4%) |
| En diálisis | 4 (3,9%) |
| Fibrilación auricular antes del TAVI | 42 (41,2%) |
| Paroxística | 13 (12,7%) |
| Permanente | 29 (28,5%) |
| Función ventricular antes del TAVI (N = 82) | |
| > 50% | 65 (79,3%) |
| 30-50% | 9 (11%) |
| < 30% | 8 (9,8%) |
| Índice STS | 5,4% (3,7-7,735) |
| Marcapasos antes del TAVI | 11 (10,8%) |
ACr: aclaramiento de creatinina; TAVI: implante percutáneo de válvula aórtica. | |
La mayor parte de los pacientes tenían una función sistólica conservada y todos estaban diagnosticados de EAo grave, con un área valvular indexada media de 0,66 ± 0,17 cm2/m2 y unos gradientes aórtico máximo y medio de 74,3 ± 23,7 y 45,6 ± 15,7 mmHg, respectivamente. El 22% de los pacientes presentaba además una IAo al menos de grado moderado (≥ 2).
Características del procedimiento
Las características del procedimiento se presentan en la tabla 3. Se realizó bajo anestesia general y guiado por ecocardiograma transesofágico en la mayoría de los pacientes. El implante fue por vía transfemoral; en el 91,2% de los casos se realizó punción percutánea guiada por escopia y cierre percutáneo.
Tabla 3. Características del procedimiento
| Características del procedimiento (N = 102) | |
|---|---|
| Anestesia general | 94 (92,1%) |
| Ecocardiograma transesofágico durante el procedimiento | 94 (92,1%) |
| Acceso transfemoral | 102 (100%) |
| Exposición quirúrgica | 8 (7,8%) |
| Percutáneo | 94 (92,1%) |
| Sistema de cierre Proglide | 38 (37,2%) |
| Sistema de cierre Prostar | 56 (54.9%) |
| Predilatación | 20 (19,6%) |
| Reposición | |
| Parcial | 12 (11,8%) |
| Completa | 1 (1%) |
| Posdilatación | 0 |
| Tamaño prótesis | |
| N.º 23 | 43 (42,1%) |
| N.º 25 | 27 (26,5%) |
| N.º 27 | 32 (31,4%) |
El tamaño de la prótesis se decidía basándose en las medidas del área y del perímetro del anillo realizadas por tomografía computarizada en cada centro. Se realizó predilatación valvular en el 19,6% de los pacientes, y no se hizo posdilatación en ningún paciente.
Antes del implante definitivo fue necesario reposicionar el dispositivo en 12 procedimientos (11,8%) y recapturar completamente la prótesis en una ocasión, por presentar el paciente una insuficiencia periprotésica grave debida a una mala colocación de la prótesis; en este paciente, se implantó de nuevo el mismo dispositivo con éxito.
Resultados del procedimiento
Se pudo implantar la prótesis en 100 pacientes (98%), y en 2 no fue posible por complicaciones vasculares mayores: en un caso por rotura de la arteria iliaca que necesitó intervención quirúrgica (con buena evolución posterior) y en el otro por rotura de la aorta antes de llegar a implantar el dispositivo (finalmente el paciente falleció). En todos los casos en los que se accedió al nivel de la válvula aórtica nativa, el dispositivo fue implantado con éxito.
Tras el implante se observó una reducción significativa de los gradientes transvalvulares, tanto medio como máximo, y del porcentaje de IAo significativa (p < 0,001) (figura 2). En un caso se produjo una fuga periprotésica de grado 2 y no hubo ninguna que fuera más grave. En el caso citado se describe un anillo grande (diámetro medido por tomografía computarizada de 27 mm, valor en los límites superiores de los recomendados por la compañía) y la causa principal de la fuga periprotésica moderada podría ser, por tanto, una escasa sobredimensión de la prótesis con respecto al tamaño del anillo.
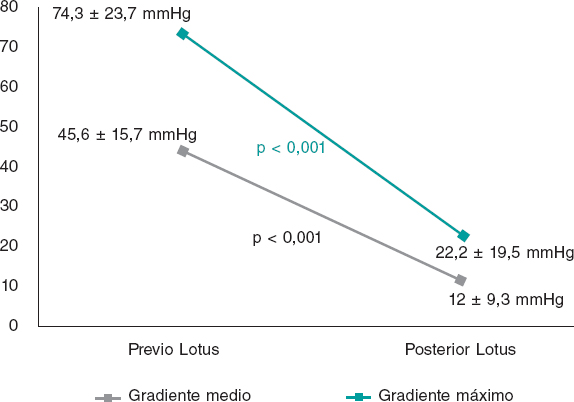
Figura 2. Gradientes previos y posteriores al implante.
No hubo ninguna complicación relacionada con una mala posición del dispositivo y solo se produjo una oclusión coronaria tromboembólica durante el procedimiento, que se resolvió rápidamente con tromboaspiración coronaria y angioplastia con balón, sin secuelas mayores (con infarto intraprocedimiento, aunque sin fallecimiento ni empeoramiento de la fracción de eyección del ventrículo izquierdo tras el procedimiento).
Las complicaciones se reportan en la tabla 4. La mortalidad intrahospitalaria fue del 3,9% (4 pacientes). Un paciente, como ya se ha comentado, falleció tras una rotura de aorta antes de llegar a implantar el dispositivo. Este paciente tenía aorta en porcelana y el ecocardiograma transesofágico realizado durante el procedimiento mostró placas ulceradas en la pared aórtica. El segundo paciente falleció por shock cardiogénico al cuarto día de ingreso; presentaba disfunción ventricular y bloqueo de la rama izquierda previos al implante de la prótesis, pero no presentó complicaciones durante el procedimiento. Un tercer paciente sufrió un ictus isquémico periprocedimiento, tuvo un ingreso prolongado y finalmente falleció el día 74 de ingreso por una infección nosocomial. Y el cuarto paciente, con antecedentes de insuficiencia hepática, presentó fracaso hepático con inestabilidad hemodinámica y falleció en los primeros 30 días tras la intervención.
Tabla 4. Resultados del procedimiento
| Resultados del procedimiento (criterios VARCS2) (N = 102) | |
|---|---|
| Éxito del implante | 100 (98%) |
| Estancia hospitalaria (días) | |
| Media | 12,8 ± 16,5 |
| Mediana | 8,5 ± 4,5 |
| Mala posición del dispositivo | 0 |
| Migración | 0 |
| Embolización | 0 |
| Valve-in-valve | 0 |
| Oclusión coronaria | 1 (1%) |
| Insuficiencia aórtica periprotésica (grado) | |
| 0 | 81 (79,4%) |
| 1 | 20 (19,6%) |
| 2 | 1 (1%) |
| 3 | 0 |
| Mortalidad intrahospitalaria | 4 (3,9%) |
| Ictus | 3 (2,9%) |
| Invalidante | 2 (1,9%) |
| No invalidante | 1 (1%) |
| Sangrado | 5 (4,9%) |
| Peligroso para la vida | 3 (2,9%) |
| Mayor | 1 (1%) |
| Menor | 1 (1%) |
| Fracaso renal | |
| Estadio 2 | 5 (4,9%) |
| Estadio 3 | 2 (2%) |
| Complicaciones vasculares | 11 (10,8%) |
| Mayores | 4 (3,9%) |
| Menores | 7 (6,9%) |
| Conversión a cirugía abierta | 1 (1%) |
| Implante de marcapasos definitivo | 33 (36,3%) |
| Parámetro combinado de eficacia | 95 (93,1%) |
| Parámetro combinado de seguridad | 92 (90,2%) |
VARC2: Valve Academic Research Consortium 2. | |
La tasa de ictus periprocedimiento fue del 2,9% y la de complicaciones vasculares mayores fue del 3,9%. Hubo 2 roturas de aorta con taponamiento cardiaco, en un caso con fallecimiento del paciente y en el otro con conversión a esternotomía y cirugía, y con buena evolución posterior. Las otras 2 complicaciones mayores fueron una rotura de la arteria iliaca y un hematoma retroperitoneal que necesitaron intervención, con buena evolución.
La tasa de éxito del implante, definido según los criterios del Valve Academic Research Consortium 2, fue del 93,1% (95 de los 102 pacientes incluidos), ya que 4 pacientes fallecieron, en un paciente no se llegó a implantar la prótesis por una complicación vascular mayor, un paciente presentaba un gradiente medio > 20 mmHg tras el implante y un paciente presentaba IAo moderada. El parámetro combinado de seguridad temprana (hasta el alta hospitalaria) se alcanzó en el 90,2% de los casos (92 de los 102 pacientes incluidos).
Se implantó marcapasos definitivo antes del alta en 33 pacientes de los 91 que no portaban marcapasos antes de la intervención (36,3%).
Seguimiento
De los 92 pacientes que alcanzaron el parámetro combinado de seguridad temprana, fue posible analizar los resultados a los 3 años de seguimiento de 57 (62%), con una edad media de 80 ± 6 años y una mediana de seguimiento de 37 meses (22-47).
La mortalidad al año fue del 10,5% (6 pacientes). Dos pacientes fallecieron por endocarditis: en un caso sobre válvula mitral (paciente con insuficiencia mitral grave orgánica previa al TAVI) a los 10 meses del procedimiento y en el otro sobre prótesis aórtica a los 3 meses del implante. Los restantes 4 pacientes fallecieron por causas no cardiovasculares (1 por encefalopatía metabólica y 3 por sepsis de otro origen). La mortalidad a los 3 años fue del 35,1% (20 pacientes): 6 pacientes (10,5% del total) por causa cardiovascular, 10 por causa no cardiovascular y 4 por causa desconocida.
En cuanto a los parámetros ecocardiográficos, se observó la persistencia de los buenos resultados a largo plazo, sin variaciones significativas en los gradientes valvulares posteriores al TAVI (gradiente medio de 12 ± 9,3 mmHg al alta frente a 12,4 ± 6,8 mmHg a los 3 años; gradiente máximo de 22 ± 19,5 mmHg al alta frente a 24,5 ± 13,2 mmHg a los 3 años). Sin embargo, se detectó trombosis protésica en 2 pacientes (3,5%), diagnosticados ambos en un control ecocardiográfico habitual, sin eventos clínicos asociados. En un caso fue una trombosis precoz, a los 2 meses del implante de la prótesis, en un paciente de 87 años, con disfunción ventricular grave e implante de una Lotus n.º 27, en tratamiento al alta con doble antiagregación. En el otro caso fue una trombosis muy tardía, a los 46 meses tras el implante de la prótesis, en un paciente de 71 años, con disfunción ventricular moderada y Lotus n.º 23. Ambos pacientes mejoraron con tratamiento anticoagulante. En el seguimiento no hubo ningún caso de insuficiencia aórtica periprotésica de grado > 1 y ningún paciente precisó una nueva intervención.
DISCUSIÓN
Este estudio es el primero que reporta los resultados en la vida real del implante de la prótesis Lotus (Boston Scientific) en la Península Ibérica, y son comparables a los publicados en otros estudios y registros previos (tabla 5)17-23, en particular a los del estudio RESPOND23. Destacan la escasa tasa de insuficiencia periprotésica (1% moderada y 0% grave), la ausencia de complicaciones derivadas del mal posicionamiento de la prótesis y la no necesidad de posdilatación a pesar de una proporción baja de predilatación. Estos resultados se obtienen esencialmente gracias a 3 factores:
Tabla 5. Estudios publicados sobre la prótesis Lotus
| Serie | N.º pacientes | Éxito del implante | Mortalidad | Insuficiencia aórtica periprotésica ≥ 2 | Marcapasos |
|---|---|---|---|---|---|
| Reprise II17,18 | 120 | 100% | 4,2% | 1% | 28,6% |
| Rampat et al.19 | 228 | 99,1% | 1,8% | 0,8% | 31,8% |
| De Backer et al.20 | 154 | 100% | 1,9% | 0,6% | 27,9% |
| Wöhrle et al.21 | 26 | 100% | 0 | 0 | 26,9% |
| RESPOND23 | 1.014 | 98,1% | 2,9% | 0,3% | 34,6% |
| Serie actual | 102 | 98% | 3,9% | 1% | 36,3% |
- Por la posibilidad de reposicionar y recuperar en parte o por completo el dispositivo, lo que permite una más precisa colocación de la prótesis.
- Por presentar la válvula una gran fuerza radial, siendo su mecanismo no de autoexpansión, sino de expansión mecánica controlada (a medida que el dispositivo sale del sistema de liberación, la estructura de nitinol se acorta y se expande, siempre de manera totalmente reversible).
- Por la presencia de un novedoso sistema de sellado (membrana de uretano) que se adapta a la superficie irregular del anillo, para minimizar la regurgitación perivalvular también en anillos muy calcificados e irregulares.
La mortalidad intrahospitalaria de nuestra población (3,9%) es parecida a la del Reprise II15 y algo mayor que la del principal registro publicado hasta la fecha, con 1014 pacientes incluidos: el estudio RESPOND23. Los resultados, sin embargo, son difícilmente comparables por diferencias tanto en las poblaciones incluidas, en particular la del estudio Reprise II, que es una población de alto riego, como en los centros reclutadores, ya que en el estudio RESPOND participaron centros con una gran experiencia en el implante de la prótesis Lotus. La población incluida en nuestro registro es de riesgo intermedio (índice STS del 4-8%), comparable con la del PARTNER 26, y la mortalidad por cualquier causa encontrada en nuestro estudio es igual a la reportada en dicho estudio (3,9% a los 30 días). Si se considera la importancia de la curva de aprendizaje cuando se analizan los resultados de dispositivos de reciente introducción, y que en nuestro registro se incluye algún centro con menos de 10 casos de experiencia, la mortalidad intrahospitalaria puede calificarse como relativamente baja. En nuestra serie, la mortalidad por causa cardiovascular fue del 3%.
Una de las ventajas de este dispositivo es que asegura la estabilidad hemodinámica del paciente durante todo el procedimiento. Por una parte, no precisa sobreestimulación para su implante. En segundo lugar, las valvas comienzan a funcionar de manera muy precoz, antes de que la válvula se acorte, puesto que están adheridas a la porción más distal del dispositivo, con lo que se evitan periodos de hipotensión. En tercer lugar, con cierta frecuencia puede implantarse directamente, sin predilatación, ya que tiene una gran fuerza radial. En nuestro registro, de hecho, se realizó predilatación solo en el 19,6% de los pacientes, menos que en el estudio RESPOND (53,9%).
La incidencia de IAo periprotésica significativa (grado ≥ 2) fue muy baja, con resultados también parecidos a los de estudios previos con Lotus (tabla 5). Solo en un paciente se observó insuficiencia periprotésica moderada y en ningún caso fue grave. La IAo periprotésica moderada-grave (grado ≥ 2) se ha asociado a peores resultados tras un TAVI, con aumento de la mortalidad a corto y largo plazo9-12. En el estudio PARTNER 2 se observó, a los 30 días, una incidencia de IAo periprotésica moderada-grave del 3,7%, y la mortalidad a los 2 años en estos pacientes fue mayor que en aquellos con insuficiencia periprotésica de grado 0-1 (p < 0,001)6. Tanto en el seguimiento realizado en nuestro registro como en el seguimiento al año del estudio Reprise II, se ha observado que los resultados encontrados en los primeros 30 días se mantienen en el tiempo, persistiendo baja la incidencia de insuficiencia periprotésica significativa también al año18. La posibilidad de reposicionar y recuperar el dispositivo antes del implante permite reducir también otras complicaciones relacionadas con una mala posición de la válvula. En nuestra población no hubo ningún caso de embolización del dispositivo y en ningún paciente fue necesario el implante de una nueva prótesis dentro de otra (valve-in-valve), lo que aumenta, por tanto, la seguridad del procedimiento.
La incidencia de accidentes cerebrovasculares en nuestro registro ha sido del 2,9% (3 pacientes, de los cuales 2 presentaron un ictus invalidante), parecida a la encontrada en el estudio RESPOND23 (total de ictus: 3%; ictus invalidante: 2,2%), aunque la ausencia de un estudio neurológico sistemático antes y después del procedimiento, así como de un comité de adjudicación de eventos, no permite sacar conclusiones definitivas ni comparar la incidencia de esta complicación en nuestro registro con la de otros estudios.
La tasa de complicaciones vasculares mayores no es diferente de la publicada en otras series y con otros dispositivos.
La asignatura pendiente en las prótesis Lotus sigue siendo la incidencia de implante de marcapasos definitivo. Como en estudios previos, la necesidad de marcapasos definitivo ronda el 30% de los casos y la causa no está todavía clara. Se han estudiado varios factores que podrían estar relacionados con esta complicación. En el Reprise II se indicó como principal factor predictor independiente de marcapasos el sobreestiramiento , definido como una relación entre el área teórica de la prótesis dividida entre el área del anillo o del tracto de salida del ventrículo izquierdo medidos por tomografía computarizada ≥10%21. Esto, junto con el hallazgo de una mayor incidencia de implante de marcapasos con algunas prótesis autoexpandibles24 y en los casos de implantes más profundos de los dispositivos25, hace pensar que el desarrollo de alteraciones de la conducción podría relacionarse con un excesivo estrés mecánico en zonas de paso del sistema de conducción, como puede ser la unión mitroaórtica26, y que posiblemente una mejor elección del tamaño de la prótesis de acuerdo con los datos de la tomografía computarizada, una modificación de la técnica para implantar la válvula con menor profundidad y la introducción en el mercado de la prótesis LOTUS Edge podrían reducir la incidencia de esta complicación. En comparación con la generación anterior del sistema valvular Lotus, LOTUS Edge es más sencillo de colocar, con un catéter más flexible y fácil de seguir. La tecnología de despliegue Depth Guard y los marcadores radioopacos añadidos contribuyen a simplificar el despliegue. La tecnología Depth Guard ha sido diseñada para minimizar la profundidad del implante de la prótesis valvular, reduciendo así la interacción con el infundíbulo ventricular izquierdo. Esta reducción del contacto con el infundíbulo ventricular izquierdo tiene como objetivo reducir las tasas de necesidad de marcapasos definitivo.
Para terminar, son muy interesantes los resultados ya publicados del estudio REPRISE III, que ha comparado de forma aleatorizada la prótesis Lotus con la prótesis valvular aórtica autoexpandible CoreValve (Medtronic, Estados Unidos)27. Los resultados disponibles confirman los de nuestro registro en cuanto a seguridad y eficacia de la prótesis Lotus, y no ha habido diferencias significativas a los 2 años en cuanto a las incidencias de mortalidad y de ictus con respecto a CoreValve. Además, en línea con nuestros resultados, se ha observado una menor incidencia de IAo periprotésica moderada-grave con Lotus a los 2 años (0,3% con Lotus frente a 3,8% con CoreValve; p < 0,01), así como de embolización del dispositivo (0,0% con Lotus frente a 2,0% con CoreValve; p < 0,01), pero con una mayor necesidad de implante de marcapasos (41,7% con Lotus frente a 26,1% con CoreValve; p < 0,01) y una mayor incidencia de trombosis protésica en el seguimiento a largo plazo, que tanto en nuestro registro como en el estudio REPRISE III ronda el 3%.
Limitaciones
Las limitaciones principales probablemente sean la ausencia de grupo de comparación y la pérdida de un porcentaje no despreciable de pacientes en el seguimiento, debido a que el objetivo inicial y principal del estudio fue evaluar los resultados intrahospitalarios del implante de la prótesis. En segundo lugar, el dispositivo que se encuentra actualmente disponible es el LOTUS Edge, que conserva las ventajas del Lotus original, con mejorías en el catéter y en el sistema de liberación. Y por último, otra limitación es la falta de un protocolo común predefinido para la inclusión de pacientes y para la recogida de los resultados, aunque esta fuera prospectiva en cada centro.
CONCLUSIONES
Se trata del primer estudio que describe los datos de seguridad y funcionamiento de la prótesis Lotus en España y Portugal. Nuestros resultados confirman los obtenidos en estudios previos, e indican que la prótesis Lotus es una alternativa eficaz y segura para pacientes con EAo grave sintomática. En particular, se describe una muy baja incidencia de IAo periprotésica tras el implante, a costa de un alta incidencia de necesidad de marcapasos.
CONFLICTO DE INTERESES
R. Moreno es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en REC: Publications para garantizar la gestión imparcial del manuscrito. R. Moreno es también proctor de Boston Scientific.
¿QUÉ APORTA DE NUEVO?
- La experiencia con este dispositivo en nuestro entorno sigue siendo limitada. La relevancia de este estudio radica en que se describen los primeros datos de seguridad y funcionamiento de la prótesis Lotus en España y Portugal. Nuestros resultados confirman los encontrados en registros previos, con una alta tasa de éxito del implante, una baja mortalidad y una baja incidencia de insuficiencia aórtica periprotésica, aunque a costa de una alta incidencia de necesidad de marcapasos. Además, en nuestro registro se reportan resultados del seguimiento a largo plazo (3 años), lo que confiere más relevancia al estudio, ya que todavía hay muy pocos datos en la literatura sobre la durabilidad de esta prótesis.
¿QUÉ SE SABE DEL TEMA?
- A pesar de la experiencia siempre creciente en el tratamiento percutáneo de la estenosis aórtica grave, persisten complicaciones asociadas al TAVI que pueden tener un impacto negativo sobre los resultados a corto y medio-largo plazo, en particular la insuficiencia aórtica periprotésica. La prótesis Lotus es una válvula aórtica transcatéter de segunda generación, completamente recuperable y reposicionable, que ha demostrado buenos resultados iniciales en cuanto a eficacia y seguridad en estudios y registros previos, con una reducción de complicaciones importantes como la insuficiencia aórtica periprotésica o la malposición del dispositivo.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63:1972-1981.
3. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
4. Adams DH, Popma JJ, Reardon MJ, et al. Core Valve Clinical Investigators. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
5. Salinas P, Moreno R, Calvo L, et al. Long term follow-up after Transcatheter Aortic Valve Implantation for severe aortic stenosis. Rev Esp Cardiol. 2016;69:37-44.
6. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
7. Mack MJ, Leon MB, Thourani VH, et al. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
8. Popma JJ, Deeb GM, Yakubov SJ, et al.;Evolut Low Risk Trial Investigators. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
9. Moreno R, Calvo L, Salinas P, et al. Causes of peri-operative mortality after transcatheter aortic valve implantation:a pooled analysis of 12 studies and 1223 patients. J Invasive Cardiol. 2011;23:180-4.
10. Tamburino C, Capodanno D, Ramondo A, et al. Incidence and predictors of early and late mortality after transcatheter aortic valve implantation in 663 patients with severe aortic stenosis. Circulation. 2011;123:299-308.
11. SabatéM, Cánovas S, García E, et al. Predictores de mortalidad hospitalaria y a medio plazo tras el reemplazo valvular aórtico transcatéter:datos del registro nacional TAVI 2010-2011. Rev Esp Cardiol. 2013;66:949-958.
12. Sinning JM, Vasa-Nicotera M, Chin D, et al. Evaluation and management of paravalvular aortic regurgitation after transcatheter aortic valve replacement. J Am Coll Cardiol. 2013;62:11-20.
13. Meredith I, Kristin L, Haratani N, Allocco D, Dawkins K. Boston Scientific Lotus Valve. EuroIntervention. 2012;8(Suppl Q):Q70-74.
14. Vahanian A, Alfieri O, Andreotti F, et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J. 2012;33:2451-2496.
15. O'Brien SM, Shahian DM, Filardo G, et al. The Society of Thoracic Surgeons 2008 cardiac surgery risk models:part-2 –isolated valve surgery. Ann Thorac Surg. 2009;88(1 Suppl):S23-42.
16. Kappetein AP, Head SJ, Genereux P, et al. Updated standardized end point definitions for transcatheter aortic valve implantation:the Valve Academic Research Consortium-2 consensus document. Eur Heart J. 2012;33:2403-2418.
17. Meredith IT, Walters DL, Dumonteil N, et al. Transcatheter aortic valve replacement for severe symptomatic aortic stenosis using a repositionable valve system:30-day primary end point results from the REPRISE II study. J Am Coll Cardiol. 2014;64:1339-1348.
18. Meredith IT, Walters DL, Dumonteil N, et al. 1-Year Outcomes With the Fully Repositionable and Retrievable Lotus Transcatheter Aortic Replacement Valve in 120 High-Risk Surgical Patients With Severe Aortic Stenosis:Results of the REPRISE II Study. JACC Cardiovasc Interv. 2016;9:376-384.
19. Rampat R, Khawaja MZ, Byrne J, et al. Transcatheter Aortic Valve Replacement Using the Repositionable LOTUS Valve:United Kingdom Experience. JACC Cardiovasc Interv. 2016;9:367-372.
20. De Backer O, Götberg M, Ihlberg L, et al. Efficacy and safety of the Lotus Valve System for treatment of patients with severe aortic valve stenosis and intermediate surgical risk:Results from the Nordic Lotus-TAVR registry. Int J Cardiol. 2016;219:92-97.
21. Wöhrle J, Gonska B, Rodewald C, et al. Transfemoral aortic valve implantation with the repositionable Lotus valve compared with the balloon-expandable Edwards Sapien 3 valve. Int J Cardiol. 2015;195:171-175.
22. Larman Tellechea M, Telleria Arrieta M, Lasa Larraya G, Sanmartin Pena JC, Gaviria Molinero K. Transcatheter aortic valve replacement with Lotus valve:initial experience. Rev Esp Cardiol. 2014;67:956-958.
23. Falk V, Wöhrle J, Hildick-Smith D, et al. Safety and efficacy of a repositionable and fully retrievable aortic valve used in routine clinical practice:the RESPOND Study. Eur Heart J. 2017;38:3359-3366.
24. Abdel-Wahab M, Mehilli J, Frerker C, et al. Comparison of balloon-expandable vs self-expandable valves in patients undergoing transcatheter aortic valve replacement:the CHOICE randomized clinical trial. JAMA. 2014;311:1503-1514.
25. De Torres-Alba F, Kaleschke G, Diller GP, et al. Changes in the Pacemaker Rate After Transition From Edwards SAPIEN XT to SAPIEN 3 Transcatheter Aortic Valve Implantation:The Critical Role of Valve Implantation Height. JACC Cardiovasc Interv. 2016;9:805-813.
26. Moreno R, Dobarro D, López de SáE, et al. Cause of complete atrioventricular block after percutaneous aortic valve implantation:insights from a necropsy study. Circulation. 2009;120:e29-30.
27. Reardon MJ, Feldman TE, Meduri CU, et al. Two-Year Outcomes After Transcatheter Aortic Valve Replacement With Mechanical vs Self-expanding Valves:The REPRISE III Randomized Clinical Trial. JAMA Cardiol. 2019;4:223-229.
Autor para correspondencia: Playa de Sitges 39, 28290 Las Rozas de Madrid, Madrid, España.
Correo electrónico: daniele.gemma@hotmail.com (D. Gemma).